Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика отдельных плазменных факторов свёртывания кровиСодержание книги
Поиск на нашем сайте
Фактор[Мф13] I (фибриноген[Мф14]) Стабильный[Мф15] белок-глобулин; Молекулярная масса — 341 000 дальтон; длина молекулы 46 нм Место синтеза — печень; Содержание в плазме — 1.8—4.0 г/л; Период полужизни в плазме после внутривенного введения — 4—5 дней; Минимальный уровень, необходимый для гемостаза — 0.8 г/л; Хромосома, кодирующая синтез — 4q23-q32. Фибриноген является плазменным глобулином,
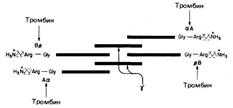
Молекула состоит из шести полипептидных цепей (две Аα-цепи, две Вβ-цепи и две γ-цепи). Структура фибриногена — Аα2Вβ2γ2 (рис. 712071610).
Рис. 712071610. Схематическое изображение фибриногена, его структуры (АαВβγ)2, заряженных концов, сайтов расщепления тромбином (стрелки) четырех пептидных связей Arg-Gly. Вβ- и γ-цепи содержат сложные олигосахариды, связанные с остатками аспарагина[Мф16] (Asn). Концы молекул фибриногена обладают сильным отрицательным зарядом; это обусловлено присутствием большого количества остатков аспартата и глутамата в А-области цепи Аα и в В-области области цепи Вβ (рис. 712071610). Помимо этого В-область цепи Вβ содержит необычно отрицательно заряженный остаток тирозин-О-сульфата. Отрицательно заряженные концы молекул фибриногена не только способствуют растворимости последних в воде, они отталкивают концы других молекул фибриногена, что предотвращает агрегацию последних. Под действием тромбина (фактор IIa), расщепляющего пептидные связи Apr—Гли, от фибриногена отщепляются четыре низкомолекулярных пептида, и он превращается в фибрин-мономер (I m), способный к аутополимеризации за счет свободных связей.
Фактор II (протромбин) Сериновая протеаза. Гликопротеин, по электрофоретической подвижности относится к a2-глобулинам; молекулярная масса — 68 000—72 000 дальтон; синтезируется в печени при участии витамина К; содержание в плазме крови — около 0.1 г/л (100 мкг/л) или 80-120% активности; период полужизни в плазме после внутривенного введения — 67—106 ч; минимальный уровень, необходимый для гемостаза — 20—40%; хромосома, кодирующая синтез — 11. Протромбин является стабильным протеином, имеет специфическую особенность — связывать кальций (одна молекула протромбина связывает 10—12 ионов Са2+), при этом происходят конформационные изменения структуры белка протромбина. Протромбин превращается в тромбин под влиянием комплекса протромбиназы.
Под действием протромбиназы от него отщепляются a-, b- и g-тромбины (фактор IIа): a-тромбин очень активен, но быстро нейтрализуется антитромбином III; b-тромбин менее активен, но устойчив к действию гепарина и антитромбина III; g-тромбин не имеет свертывающей активности, но обладает фиб-
Фактор III (тканевый тромбопластин) [k] Это комплекс липопротеиновой природы с очень высокой молекулярной массой до 167 000 000 дальтон. Он содержится в различных тканях — легких, головном мозге, печени, плаценте, почках, эндотелии сосудов (в эндотелиальных клетках в небольшом количестве) и выделяется в кровь при повреждении тканей. В присутствии ионов кальция активирует фактор VII и участвует в трансформации протромбина в тромбин.
Апопротеин III в комплексе с фосфолипидами; входит в состав мембран клеток многих тканей; эритроциты, лейкоциты и тромбоциты содержат только лицидный комплекс — при контакте с фактором VIIa и IV способен активировать фактор X (по быстрому пути). Он является матрицей для развертывания реакций образования протромбиназы, что обеспечивает высокую локальную концентрацию факторов свертывания;
|
|||||
|
Последнее изменение этой страницы: 2017-01-27; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.34.211 (0.009 с.) |