Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятия «гемостаз», «система регуляции агрегатного состояния крови»Стр 1 из 9Следующая ⇒
Понятия «гемостаз», «система регуляции агрегатного состояния крови»
Для выполнения своей функции кровь должна находиться в жидком состоянии в сосудистом русле. Повреждение стенки сосуда приводит к выходу крови из сосудов – кровотечению. Процесс остановки кровотечения как за счёт внутренних, так и внешних механизмов называется гемостазом. Например, если хирург останавливает кровотечение, говорят, что он осуществляет гемостаз. В организме есть собственные механизмы остановки кровотечений и структуры, обеспечивающие этот процесс, объединённые в систему гемостаза. Основным физиологическим механизмом остановки кровотечения является образование тромбов при повреждениях сосудистой стенки (тромбирование).
Система гемостаза включает три компонента[Мф1]: Стенки кровеносных сосудов. Форменные элементы крови (в первую очередь тромбоциты). Плазменные ферментные системы[Мф2].
Различают два основных механизма остановки кровотечения при повреждении сосудов:
1. Первичный, или сосудисто-тромбоцитарный гемостаз 2. Вторичный, или коагуляционный гемостаз.
Первичный, или сосудисто-тромбоцитарный гемостаз, обусловленный спазмом сосудов и их механической закупоркой агрегатами тромбоцитов с образованием так называемого “белого тромба”.
Вторичный, или коагуляционный гемостаз, протекающий с использованием многочисленных факторов свертывания крови и обеспечивающий плотную закупорку поврежденных сосудов фибриновым тромбом (красным кровяным сгустком).
Следует помнить, что оба механизма могут функционировать одновременно и сопряженно. Обратите внимание, что под «гомеостазом» понимают постоянство внутренней среды, под «гемостазом» изменение агрегатного состояния крови, а не постоянство агрегатного состояния крови.
Понятие «система регуляции агрегатного состояния крови (РАСК)»
Способность крови осуществлять гемостаз должна быть уравновешена механизмами, обеспечивающими жидкое состояние крови, если необходимость образования тромба отсутствует. Тромбообразование в физиологических условиях является локальным процессом. Механизмы изменения агрегатного состояния крови и структуры, обеспечивающие этот процесс, объединяются в систему регуляции агрегатного состояния крови (РАСК).
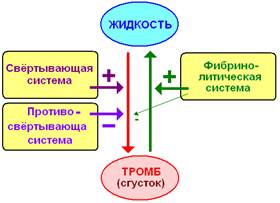
Система РАСК включает следующие системы крови: 1. свёртывающую (коагуляционный гемостаз) 2. противосвёртывающую 3. фибринолитическую
Взаимодействие системы РАСК показано на рис. 712060859.
Рис. 712060859. Взаимодействие системы РАСК.
Гемостатический потенциал[Мф3]
Гемостатический потенциал - показатель баланса свертывающей и противосвертывающей систем. Существуют следующие виды гомеостатического потенциала: нейтральный — свертывающая система функционально уравновешена с противосвертывающей; положительный — преобладание свертывающей системы (риск тромбоза); отрицательный — преобладание противосвертывающей системы (риск кровотечения). Эти три вида гемостатического потенциала могут относиться как целиком к системе кровообращения (общий потенциал), так и к какому-либо участку кровообращения (локальный потенциал).
Методы исследования сосудисто-тромбоцитарного гемостаза
Выбор методов оценки сосудисто-тромбоцитарного гемостаза зависит в первую очередь от клинической картины заболевания и склонности больного к кровотечениям или тромбозам. Существуют основные (базисные) и дополнительные тесты оценки первичного гемостаза. Ниже приведено описание наиболее распространенных базисных методов исследования. Резистентность (ломкость) капилляров
Время кровотечения
Многочисленные модификации теста основаны на точном измерении длительности кровотечения из ранки на мочке уха, мякоти ногтевой фаланги пальца руки или верхней трети ладонной поверхности предплечья.
Метод Дьюка
Предварительно мочку уха согревают между пальцами. Стерильным скарификатором или плоским ланцетом прокалывают нижний валик мочки уха (глубина прокола 3,5—4,0 мм) и включают секундомер.
Выступающие капли крови каждые 30 с промокают фильтровальной бумагой, не прикасаясь к ранке. Как только наступит момент, когда новые капли крови не образуются, выключают секундомер и определяют общую длительность кровотечения, а также оценивают размеры капель (рис. 712051042).
Рис. 712051042. Определение времени кровотечения по Дьюку (а) у здорового человека (время кровотечения 3,5 мин.) и (б) у больного с выраженной тромбоцитопенией (время кровотечения 20 мин.)
В норме время кровотечения по Дьюку не превышает 4 мин. Его увеличение наблюдается при выраженных тромбоцитопениях или/и тяжелых нарушениях их функции (тромбоцитопатиях). Следует помнить также, что у 60 % больных с этой патологией тест оказывается отрицательным, и время кровотечения нормально. Метод Айви Несколько более чувствительным является тест Айви, когда оценивают время кровотечения из надрезов на коже ладонной поверхности верхней трети предплечья на фоне искусственного повышения венозного давления с помощью манжеты для определения АД, в которой поддерживают давление 40 мм рт. ст. (рис. 1.87).
Рис. 1.87. Определение времени кровотечения по Айви. Схема
В норме время кровотечения по Айви не превышает 8 минут.
Подсчет числа тромбоцитов
Наибольшее распространение в настоящее время получили три метода подсчета тромбоцитов в крови: 1. Подсчет в камере Горяева; 2. Подсчет в мазках крови; 3. Электронно-автоматический метод.
Подсчет в камере Горяева Метод подсчета тромбоцитов в камере Горяева является самым точным, но достаточно трудоемким. Подсчет тромбоцитов в 1 л проводится по стандартной методике с учетом разведения крови и объема большого квадрата счетной сетки Горяева с применением фазово-контрастного микроскопа для лучшего контрастирования тромбоцитов. Исследуемую кровь разводят в 200 раз раствором аммония оксалата или раствором, содержащим кокаина гидрохлорид, натрия хлорид, фурациллин и дистиллированную воду. Разведенную кровь перемешивают и оставляют на 30 минут для гемолиза эритроцитов. Заполняют камеру Горяева и подсчитывают тромбоциты в 25 больших квадратах. Практически для расчета количества тромбоцитов в 1 л крови число сосчитанных в 25 больших квадратах кровяных пластинах умножают на 2х106. Ретракция сгустка крови В клинической практике чаще используют непрямые методы оценки ретракции сгустка. Один из них заключается в определении объема сыворотки, выделяемой при ретракции сгустка крови, по отношению к объему плазмы исследуемой крови (рис. 1.89).
Рис. 1.89. Схема определения ретракции кровяного сгустка. а, б, в — последовательные этапы исследования. Объяснение в тексте
В градуированную центрифужную пробирку набирают 5 мл крови, опускают в нее деревянную палочку и помещают пробирку в водяную баню (рис. 1.89, а). В исследуемой крови определяют показатель гематокрита. Через 1 ч после свертывания крови сгусток, прикрепившийся к палочке, удаляют, дав жидкой части стечь обратно в пробирку (рис. 1.89, б). Далее измеряют объем жидкости, оставшейся в пробирке, центрифугируют ее при 3000 об/мин в течение 5 минут и измеряют объем осевших эритроцитов (рис. 1.89, в). Искомый объем сыворотки определяют по разнице между объемом оставшейся в пробирке жидкости и объемом эритроцитов.
Ретракцию сгустка рассчитывают по формуле: Ретракция сгустка = ОС/ОП; где ОС — объем сыворотки после ретракции сгустка;
ОП — объем плазмы перед началом исследования.
Объем плазмы можно определить следующим образом: ОП = ОК ´ (100 - Ht)/100 где ОК — объем исследуемой крови; Ht — гематокрит.
Объем сыворотки крови после ретракции сгустка всегда меньше объема плазмы перед началом исследования, так как часть жидкой части крови остается в сгустке. Чем больше сокращается сгусток, тем больше в пробирке образуется сыворотки, и наоборот.
Теория Шмидта–Моравитца Способность крови свертываться с образованием сгустка в просвете кровеносных сосудов при их повреждении была известна с незапамятных времен. Основы ферментативной теории свёртывания крови были предложены профессором Юрьевского (ныне Тартуского) университета А.А.Шмидтом (работы 1872—1895 гг.). Первоначально она сводилась к следующему: свёртывание крови – ферментативный процесс; для свёртывания крови необходимо присутствие трех веществ: фибриногена, фибринопластического вещества и тромбина. В результате дальнейших исследований А.А. Шмидта и его школы, а также Моравитца, Гаммарстена, Спиро и др. было установлено, что образование фибрина происходит за счет одного предшественника – фибриногена. Через 20 лет после открытия тромбина была сформулирована классическая ферментативная теория свёртывания крови, которая в литературе получила название теории Шмидта–Моравитца. Схематически теория Шмидта–Моравитца может быть представлена в следующем виде:
Сравнительно простая по своей сути теория Шмидта–Моравитца в дальнейшем необычайно усложнилась, обросла новыми сведениями, «превратив» свёртывания крови в сложнейший ферментативный процесс.
Фактор II (протромбин) Сериновая протеаза. Гликопротеин, по электрофоретической подвижности относится к a2-глобулинам; молекулярная масса — 68 000—72 000 дальтон; синтезируется в печени при участии витамина К; содержание в плазме крови — около 0.1 г/л (100 мкг/л) или 80-120% активности; период полужизни в плазме после внутривенного введения — 67—106 ч; минимальный уровень, необходимый для гемостаза — 20—40%; хромосома, кодирующая синтез — 11. Протромбин является стабильным протеином, имеет специфическую особенность — связывать кальций (одна молекула протромбина связывает 10—12 ионов Са2+), при этом происходят конформационные изменения структуры белка протромбина. Протромбин превращается в тромбин под влиянием комплекса протромбиназы.
Под действием протромбиназы от него отщепляются a-, b- и g-тромбины (фактор IIа): a-тромбин очень активен, но быстро нейтрализуется антитромбином III; b-тромбин менее активен, но устойчив к действию гепарина и антитромбина III; g-тромбин не имеет свертывающей активности, но обладает фиб-
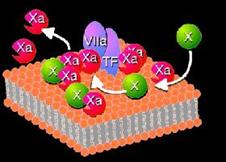
Фактор III (тканевый тромбопластин) [k] Это комплекс липопротеиновой природы с очень высокой молекулярной массой до 167 000 000 дальтон. Он содержится в различных тканях — легких, головном мозге, печени, плаценте, почках, эндотелии сосудов (в эндотелиальных клетках в небольшом количестве) и выделяется в кровь при повреждении тканей. В присутствии ионов кальция активирует фактор VII и участвует в трансформации протромбина в тромбин.
Апопротеин III в комплексе с фосфолипидами; входит в состав мембран клеток многих тканей; эритроциты, лейкоциты и тромбоциты содержат только лицидный комплекс — при контакте с фактором VIIa и IV способен активировать фактор X (по быстрому пути). Он является матрицей для развертывания реакций образования протромбиназы, что обеспечивает высокую локальную концентрацию факторов свертывания;
Фактор V (проакцелерин)
Является предшественником активного фактора акцелерина (Va). Основные характеристики: • гликопротеин, относится к глобулиновой фракции крови; • молекулярная масса — 330 000 дальтон; • синтезируется в печени и мегакариоцитах; • содержание в плазме крови — 0.007—0.01 г/л или 70—150% активности; • период полужизни в плазме после внутривенного введения — 12-36 ч; • минимальный уровень, необходимый для гемостаза — 10—25%; • хромосома, кодирующая синтез — Iq21—25.
Фактор V циркулирует в плазме в виде одиночного полипептида, асимметричного гликопротеида. Фактор V, синтезируемый в печени, превращается в фактор V плазмы, а фактор V, синтезируемый в мегакариоцитах, — в тромбоцитарный фактор V[Мф17]. Фактор V превращается в активный кофактор (Va) под влиянием протеолитического действия тромбина и фактора Ха.
Фактор VII (проконвертин) Предшественник конвертина (VIIа[Мф18]).
Основные характеристики: • гликопротеин, относится к β‑глобулинам; • синтезируется в печени при участии витамина К; • молекулярная масса — 63 000 дальтон; • содержание в плазме крови — около 0.005 г/л или 80—120 % активности; • период полужизни в плазме после внутривенного введения — 4—6 ч; • минимальный уровень, необходимый для гемостаза — 5—10 % • хромосома, кодирующая синтез — 13 Активная форма фактора VII является сериновой протеазой. Механизм образования конвертина (VIIа) окончательно не выяснен. Активируется факторами III, IIa. Фактор VII участвует во внешнем пути активации свертывания крови.
Фактор VIII (антигемофильный глобулин А)
В крови фактор VIII циркулирует в виде комплекса, состоящего из нескольких субъединиц. В целом фактор VIII подразделяется на две составные части: с высокой молекулярной массой и низкой молекулярной массой. Высокомолекулярная часть состоит из фактора фон Виллебранда (vWF), фактора VIII R:RCo, VIII R:Ag, низкомолекулярная часть состоит из фактора VIII C и VIII Ag. Фактор VIII:C— субъединица фактора VIII, обладающая прокоагулянтной активностью. Основные характеристики фактора VIII C: • гликопротеин, относится к глобулиновой фракции крови; • молекулярная масса — 267 000 дальтон; • синтезируется синусоидными клетками печени, возможно, другими эндотелиальными клетками, гепатоцитами; • содержание в плазме крови — 0.01—0.02 г/л или 60—250 % активности; • период полужизни в плазме после внутривенного введения 10—12 ч; • минимальный уровень, необходимый для гемостаза — 35-30%; • хромосома, кодирующая синтез — Xq28. Предполагается, что основным местом синтеза фактора VIII:C являются синусоидные клетки печени. Возможно, гепатоциты также продуцируют фактор VIII:C. Фактор VIII:C циркулирует в крови в связи с фактором фон Виллебранда, который, таким образом, является белком‑носителем для фактора VIII:C и защищает его от протеолитического разрушения. Фактор VIII:C играет исключительно важную роль в свертывании крови, так как является кофактором фактора IХа и тем самым ускоряет активацию фактора X. Для того чтобы сыграть роль кофактора IX, фактор VIII:C должен быть активирован. Активирование фактора VIII:C происходит под влиянием протеолитического действия тромбина. Тромбин отделяет от комплекса VIII:C/vWF фактор фон Виллебрандаи расщепляет фактор VIII:C на тяжелую и легкую цепи, что приводит к активированию фактора VIII:С. Факторы VHIC:Agu VIIIR:Ag являются антигенами фактора VIII. Фактор VIII R:RCo — это активируемый ристоцетином кофактор, который необходим для агрегации тромбоцитов, индуцированной антибиотиком ристоцетином. Фактор фон Виллебранда (vWF) — это большой адгезивный гликопротеин, который содержится в плазме, α-гранулах тромбоцитов и в эндотелии сосудов. Он синтезируется эндотелиальными клетками и мегакариоцитами, состоит из мультимеров с молекулярной массой от 800 000 до 20 000 000 дальтон[Мф19]. Мультимеры состоят из субъединиц с молекулярной массой 220 000 дальтон. Концентрация vWF в плазме составляет 5—10 мкг/мл (5—10 мг/л). Фактор фон Виллебранда играет важную роль в осуществлении гемостаза. Ему присущи следующие функции: • способствует адгезии тромбоцитов к субэндотелию, который обнажается при повреждении сосуда; прикрепление тромбоцитов к эндотелию происходит путем связывания фактора фон Виллебранда с рецепторами, расположенными на поверхности тромбоцитов — гликопротеинами Ib (GPIb) и Ilb/IIIa (GPHb/IIIa); • является белком-носителем прокоагулянтного фактора VIIIC, препятствуя быстрому его выведению из кровотока; • защищает лабильный фактор VIII:C от протеолитического разрушения; • стабилизирует молекулу VIII:C; • повышает концентрацию фактора VIII:C в месте повреждения сосуда.
Синтез фактора фон Виллебранда кодируется геном, который находится на хромосоме XII и содержит 52 экзона.
Образование протромбиназы по внешнему пути
Повреждение тканей приводит к освобождению тканевых фосфолипидов (фактор III). Тканевые фосфолипиды активируют проконвертин (VII ® VIIa), образуется его комплекс с фактором III и Са2+. Конвертин (фактор VIIa) в составе этого комплекса активирует переход X ® Ха, образуется тканевая протромбиназа. Образование протромбиназы по внутреннему пути
Внутренний путь свертывания осуществляется внутри кровеносных сосудов при повреждении эндотелия или при появлении чужеродной отрицательно заряженной поверхности[Мф21]. Процесс внутреннего свертывания начинается с активации «факторов контакта»: фактора XII (Хагемана), прекалликреина (фактора XIV) и высокомолекулярного кининогена прекалликреина (фактора XV[Мф22]). Эти факторы связываются с коллагеном, базальной мембраной эндотелия или с отрицательно заряженной чужеродной поверхностью, образуют комплекс и взаимно активируют друг друга, что выражается в изменении молекулярной структуры каждого компонента[Мф23].
При этом прекалликреин превращается в калликреин, неактивный ф. XII – в ф. XIIa. Активный ф. XIIа в присутствии своего кофактора, высокомолекулярного кининогена, превращает ф. XI в ф. XIa, который в свою очередь воздействует на ф. IX, переводя его в ф. IXa. Ф. IXa, вместе с ф. VIIIa, фосфолипидами и ионами кальция образуют комплекс, который активирует ф. Х и запускает процесс свертывания крови по общему пути. В плазме крови имеются все вещества, которые необходимы для осуществления внутреннего пути свертывания: отрицательно заряженная поверхность (коллаген поврежденной сосудистой стенки), фосфолипиды (тромбоциты), циркулирующие неактивные факторы и кофакторы.
Повреждение эндотелия вызывает активацию фактора контакта (XII ® ХIIа). Фактор ХIIа активирует прекалликреин (фактор XIV) и его перехода в калликреин (фактор XlVa). Фактор XlVa дополнительно активирует переход XII ® ХIIа (положительная обратная связь). Фактор XIIа вызывает активацию плазменного предшественника тромбопластина (XI ® ХIа);
Tissue Factor - VIIa to Thrombin Pathway[Мф24]
Фактор ХIа активирует антигемофильный глобулин В (IX ® IХа), который образует комплекс с антигемофильным глобулином А (VIII), фактором Р3 тромбоцитов и Са2+ (при этом фактор VIII является рецептором для IХа, увеличивая его активность в 500 раз); Фактор IХа в составе вышеназванного комплекса активирует фактор X, образуется протромбиназа (Ха + Va + Р3 + + Са2+);
Образование тромбина (фаза II, общий путь)
Завершает процесс свертывания так называемый общий путь. Активированный фактор Ха превращает неактивный протромбин в гиперактивный фермент тромбин, тромбин отщепляет от молекулы растворимого фибриногена 4 фибринопептида, оставшиеся мономеры ассоциируют в полимер фибрин, ф. XIII завершает процесс, образуя ковалентные связи внутри молекулы фибрина, что делает молекулу нерастворимой и резистентной к лизису[Мф25].
Под действием протромбиназы (с участием Са2+, акцелерина Va и Р3) из протромбина (II) образуется тромбин (IIа) (2 —5 с). Р3 тромбоцитов повышает активность протромбиназы в 1 000 раз!.
Образование фибринового тромба (фаза III)
Длится 2 — 5 с.
Тромбин (IIa) приводит к отщеплению от фибриногена (I) четырех низкомолекулярных пептидов, и фибриноген превращается в фибрин-мономер (Im), имеющий свободные связи; Благодаря этим связям молекулы Im образуют сеть волокон фибрина — фибрин-S-полимер (Is) (растворимый фибрин, чувствительный к плазмину); Фибрин S под действием фибринстабилизирующего фактора (ХШа), образующего специфические изопептидные связи между полимеризованными молекулами фибрина-мономера, образуется нерастворимый фибрин-I-полимер (Ii) (нечувствителен к плазмину), составляющий фибриновый тромб (его трехмерная сеть захватывает из кровотока форменные элементы — преимущественно эритроциты — и не пропускает их во внесосудистое пространство).
Посткоагуляционная фаза
Посткоагуляционная фаза (около 70 мин) — ретракция тромба (уменьшение его объема примерно на 50 %) осуществляется с участием сократительных белков тромбоцитов, находящихся в тромбе, и приводит к окончательному гемостатически полноценному тромбу.
Феномен паракоагуляции
Следует упомянуть еще об одном возможном пути превращения фибриногена в фибрин на конечной стадии свертывания крови — о так называемом феномене паракоагуляции, который наблюдается, например, при синдроме диссеминированного внутрисосудистого свертывания крови (ДВС-синдроме). В отличие от обычного (описанного выше) процесса полимеризации волокон фибрина из его мономеров, при этом синдроме значительно снижается чувствительность к тромбину и нарушается процесс полимеризации фибрин-мономеров. Это происходит в результате того, что часть фибрин-мономеров образуют с фибриногеном и продуктами его распада комплексные крупно- и среднемолекулярные соединения — растворимые фибрин-мономерные комплексы (РФМК). Они плохо реагируют на действие тромбина, обладая относительной тромбинрезистентностью, но образуют гель при добавлении к плазме этанола, протаминсульфата или бета-нафтола. Это и есть феномен неферментативного свертывания, или феномен паракоагуляции. Выявление РФМК имеет важное значение для диагностики ДВС-синдрома.
Время свертывания крови Метод Моравитца В клинике до сих пор используется еще один упрощенный метод определения времени свертывания крови (метод Моравитца). Он применяется, в основном, для динамического контроля за состоянием гемокоагуляции при лечении прямыми антикоагулянтами. На предметное стекло наносят каплю крови, взятую из пальца или мочки уха (рис. 1.96). Включив секундомер, каждые 20–30 с в каплю крови опускают тонкий стеклянный капилляр. Время свертывания определяют в момент появления первой тонкой нити фибрина при вытягивании капилляра из капли крови. В норме свертывание крови составляет около 5 мин.
Рис. 1.96. Определение времени свертывания крови по Моравицу (схема)
Определение времени свертывания крови (унифицированный двупробирочный метод Ли —Уайта).
Рис. 1.95. Схема определения времени свертывания крови. Объяснения в тексте
Принцип: определение времени спонтанного свертывания нестабилизированной крови при 37 °С в несиликонированной и силиконированной пробирках. Норма составляет 5 – 7 мин в несиликонированной и 15 – 25 мин в силиконированной пробирках. Оценка результатов: увеличение времени свертывания наблюдается при дефиците факторов свертывания (I, II, VIII) и/или увеличении в крови антикоагулянтов. Укорочение времени указывает на тенденцию к гиперкоагуляции.
Определение времени рекальцификации плазмы (унифицированный метод). Принцип: определяют время свертывания цитратной плазмы после добавления хлорида кальция (рекальцификация). Тест характеризует преимущественно I фазу свертывания. Норма составляет 60 ‑ 120 с. Оценка результатов: увеличение времени говорит о снижении свертывания крови, снижение времени — об увеличении свертывания крови.
Активированное частичное (парциальное) тромбопластиновое время (АЧТВ)
Тест АЧТВ является одним из самых информативных и самых распространенных скрининговых тестов, который чувствителен к дефициту всех факторов свертывания крови (кроме ф.VII), к гепарину, к специфическим ингибиторам (антитела к ф.VIII и IX) и к неспецифическим ингибиторам (системная красная волчанка[Мф31]). Метод моделирования процесса внутреннего свертывания в системе in vitro был предложен в 1953 г. (Langdell, Wagner, Brinhous) и первоначально осуществлялся на стеклянной поверхности[Мф32]. Однако стекло активировало процесс по-разному в зависимости от марки, методов обработки, применяемого моющего средства. С целью стандартизации в качестве активатора (отрицательно заряженной поверхности) стали использовать каолин, целит, бентонит и ряд других веществ с отрицательно заряженной поверхностью, в последние годы – растворимую в воде эллаговую кислоту. При проведении теста используют также фосфолипиды растительного и животного происхождения или их смесь и ионы кальция для рекальцификации плазмы после действия цитрата. С целью стандартизации реакцию проводят при постоянной температуре (37°С[Мф33]).
Принцип метода заключается в определении времени свертывания плазмы в условиях стандартизации не только контактной, но и фосфолипидной (тромбопластиновой) активации факторов свертывания. С этой целью к плазме добавляют смесь каолина и кефалина (тромбопластиновый активатор), а также кальция хлорид и по секундомеру определяют время свертывания плазмы.
До настоящего времени в ряде лабораторий проводят 2 других аналогичных, но лишь частично стандартизированных теста: ЧТВ (частичное тромбопластиновое время или кефалиновое время) и АВР (активированное время рекальцификации или каолиновое время). ЧТВ, кефалиновое время, определяют при добавлении в исследуемую плазму фосфолипидного компонента (кефалина) и кальция хлористого; АВР, коалиновое время, - при добавлении в исследуемую плазму фактора контакта (каолина) и кальция хлористого, тест чувствителен к волчаночному антикоагулянту. Тест АЧТВ не имеет стандарта ВОЗ, так как для его проведения применяют различные реагенты. В качестве заменителя тромбоцитарного фактора 3 используют тромбоциты, фосфолипиды животного происхождения (мозг кроликов, быка или человека), растительные фосфолипиды (сои), смесь растительных и животных фосфолипидов, фосфолипиды из мембран эритроцитов человека: эрилид, эритрофосфатид. АЧТВ-реагенты различаются также по типу и концентрации активатора, типу буфера, присутствию защитных добавок. Было установлено, что именно фосфолипидные реагенты являются тем компонентом, который преимущественно влияет на результаты АЧТВ-теста, и оптимальными являются те реагенты, в которых соотношение фосфатидил-серина и фосфатидил-холина такое же, как в факторе 3 тромбоцитов.
В норме АЧТВ (кефалин-каолиновое время) составляет 35–50 с. Уменьшение АЧТВ свидетельствует о гиперкоагуляции и склонности к тромбозам, увеличение — о гипокоагуляции крови.
АЧТВ удлиняется также при наличии в крови ингибиторов свертывания (гепарина) и может быть использован как чувствительный тест для контроля за лечением гепарином. Определение толерантности плазмы к гепарину (унифицированный метод Горстмена). Принцип: определяют время рекальцификации цитратной плазмы в присутствии гепарина. Норма составляет 11 — 16 мин. Оценка результатов: если после добавления гепарина время свертывания больше, чем в контроле, это указывает на понижение толерантности к гепарину и на снижение свертывающих свойств крови. Уменьшение времени свертывания в этих условиях свидетельствует о повышении толерантности к гепарину и повышении свертывающей активности крови. Определение протромбинового времени (унифицированный метод Квика). Принцип: определяют время свертывания цитратной плазмы в присутствии тканевого тромбопластина и хлорида кальция. Тест позволяет судить об образовании протромбиназы по внешнему пути. Норма составляет 12— 20 с. Оценка результатов: увеличение времени свертывания указывает на снижение концентрации плазменных факторов II, V, VII, X более чем на 60 % от нормы или концентрации фибриногена менее 1 г/л, т. е. о тенденции к гипокоагуляции крови. Уменьшение времени свертывания свидетельствует об увеличении концентрации этих факторов или фибириногена и тенденции к гиперкоагуляции крови.
Тромбоэластограмма. Показатель свертывающей и противосвертывающей систем (рис. 3.4). > Время реакции R (8—10 мин) — интервал от начала записи до расхождения плеч тромбоэластограммы на 1 мм, что соответствует образованию первых волокон фибрина. > Время свертывания К (6 —-8 мин) — интервал от расхождения плеч тромбоэластограммы от 1 до 20 мм, характеризует образование фибринового сгустка определенной прочности. > Максимальная амплитуда МЛ (45 — 60 мм) — наибольшее расхождение между плечами тромбоэластограммы, характеризует максимальную эластичность сгустка.
Тромбоэластография
Широкое распространение в клинической практике получил метод тромбоэластографии, который позволяет регистрировать свертывание крови и изменения упругости сгустка крови во времени (ретракцию и лизис). Основной частью любого типа тромбоэластографа (гемокоагулографа) является кювета, в которую вносят исследуемую кровь (рис. 1.99). В кювету погружают стержень с диском или пластиной на конце, которая не касается ее стенок. Стержень связан с регистрирующим устройством тромбоэластографа. Специальное устройство придает кювете колебательно-вращательные движения, которые могут передаваться на стержень (и регистрирующее устройство), только когда в кювете, заполненной кровью, начнется образование нитей фибрина. По мере образования и уплотнения сгустка амплитуда колебаний стержня увеличивается и достигает максимума (рис. 1.100, а).
Рис. 1.99. Устройство тромбоэластографа (схема). Объяснение в тексте
Предложено множество количественных показателей тромбоэластограммы, три из которых заслуживают внимания: 1. Время реакции (R) — время от начала исследования до начала свертывания крови (первых отклонений тромбоэластограммы от прямой линии). 2. Время коагуляции (К) — время от начала движений стержня прибора до момента, когда амплитуда тромбоэластограммы составит 20 мм. 3. Максимальная амплитуда (МА) тромбоэластограммы. Считается, что время R характеризует в основном первую фазу коагуляции, а время К — интенсивность образования фибрина. Нормальные величины приведенных трех показателей тромбоэластограммы обычно устанавливают эмпирически для каждого прибора. В среднем у здоровых людей время реакции (R) составляет 4-10 мин, время коагуляции (К) — 5-7 мин, а максимальная амплитуда (МА) — 45-65 мин.
Рис. 1.100. Тромбоэластограмма в норме (а), при гиперкоагуляции (б) и гипокоагуляции (в). Схема
Первичные антикоагулянты Первичные антикоагулянты имеются в крови до начала свертывания:
• антитромбин III • гепарин • a1-антитрипсин • протеин С • тромбомодулин • антитромбопластины
• антитромбин III (в основном образуется в эндотелии и в печени) — плазменный кофактор гепарина. При отсутствии гепарина его активность уменьшается в 700 раз. В активной форме составляет 90 % всей антитромбиновой и 70 % антикоагулянтной активности крови. Ингибирует тромбин (фактор Па), а также факторы Ха, IXa, XIa (специфическим ингибитором тромбина является пептид гирудин, образуемый пиявками); • гепарин (сульфатированные полисахариды, образуются тучными клетками особенно печени и легких) образует комплекс с антитромбином III, превращая его в активный антикоагулянт. В малых концентрациях ингибирует образование протромбиназы (фазу I), в высоких концентрациях тормозит все три фазы коагуляции, активирует фибринолиз. Комплекс «гепарин + антитромбин III» может фиксироваться на мембране эндотелиальных клеток, обеспечивая тромборезистентность сосудистой стенки; • a1-антитрипсин ингибирует тромбин (Па), факторы ХПа, IXa, XIa; • протеин С (сериновая протеаза, образуется в печени с участием витамина К) инактивирует факторы Va, VIII, ускоряет фибринолиз. Сам активируется тромбином, протеином S, тромбомодулином; • тромбомодулин (образуется в эндотелии) блокирует рецепторы для тромбина на эндотелиоцитах, активирует протеин С; • антитромбопластины ингибируют факторы III и VIIa. Вторичные антикоагулянты Вторичные антикоагулянты образуются в процессе свертывания крови и фибринолиза: • атитромбин I — это фибрин, который адсорбирует и инактивирует тромбин, факторы Va, Ха; • антитромбин VI — это продукты фибринолиза, которые блокируют фибриноген и фибрин-мономер, тромбин и фактор XIa.
Фибринолиз
|
||||||||||||||
|
Последнее изменение этой страницы: 2017-01-27; просмотров: 545; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.170.183 (0.273 с.) |


 Запомните
Запомните