
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Объемный (титриметрический) анализ ⇐ ПредыдущаяСтр 8 из 8
Краткие теоретические сведения Объемным анализом называют группу методов, основанных на измерении объема раствора с известной концентрацией, который необходимо добавить к пробе для протекания аналитической реакции в соответствии со стехиометрическим уравнением. Добавляемый реагент называют титрантом, а его раствор с заданной концентрацией – титрованным раствором. Для анализа с помощью мерной пипетки отбирают от растворенной пробы точный объем, называемый аликвотным. Задача состоит в определении эквивалентной точки – состояния системы, в котором полностью, в эквивалентных соотношениях, прореагировали определяемый элемент и титрант. Эту задачу решают путем титрования – добавления по каплям к аликвоте пробы раствора титранта. Первая избыточная капля титранта вызывает изменение окраски индикатора или физико-химических свойств раствора (электропроводности, электродного потенциала и т.п.), по которому определяют эквивалентную точку. Соответствующий ей объем титранта называют эквивалентным. В точке эквивалентности выполняется соотношение, называемое законом эквивалентности для растворов:
где СN – нормальная концентрация раствора пробы, экв/л; Va – объем пробы, взятый для титрования (аликвота), мл; СТ – нормальная концентрация раствора титранта, экв/л; VЕ – эквивалентный объем титранта, мл. Пользуясь законом эквивалентов рассчитывают концентрацию вещества в пробе раствора по данным о концентрации титранта, его эквивалентного объема и объема аликвоты. При использовании метода комплексонометрии при расчете результатов по формуле используют не нормальные, а молярные концентрации Примеры решения задач Пример 25. Навеску 0,5251 г технического гидроксида калия растворили в мерной колбе емкостью 100 мл. На титрование 20 мл раствора с фенолфталеином израсходовали 18,0 мл 0,1000 н. HCl. Вычислить массовую долю KOH в образце Решение. 1. По формуле (2) рассчитаем концентрацию 100 мл раствора гидроксида калия:
2. Для гидроксида калия число обменных эквивалентов равно 1, следовательно СN = CM = 0,09 моль/л. 3. Определим количество вещества гидроксида калия в 100 мл раствора:
4. найдем массу гидроксида калия:
5. Рассчитаем массовую долю чистого KOH в техническом продукте:
Пример 26. Вычислить молярность раствора серной кислоты, если на титрование 20,00 мл его израсходовано 19,20 мл 0,1 н. гидроксида натрия. Решение. 1. По формуле (2) рассчитаем нормальную концентрацию раствора серной кислоты:
2. Для серной кислоты число обменных эквивалентов равно 2, следовательно СM = 0,5 CN = 0,048 моль/л. Задачи для решения 201. Какова молярная концентрация серной кислоты, если на титрование 0,4519 г буры Na2B2O7×10H2O израсходовали 16,43 мл этого раствора? 202. Из 6,2270 г буры Na2B2O7×10H2O приготовили 250 мл раствора. На титрование аликвоты 25 мл этого раствора израсходовали 24,17 мл соляной кислоты. Определить нормальную концентрацию растворов буры и соляной кислоты. 203. Для нейтрализации 20 мл 0,2215 н. раствора соляной кислоты требуется 21,4 мл раствора Ва(ОН)2. На нейтрализацию 25 мл уксусной кислоты требуется 22,55 мл раствора гидроксида бария. Вычислить нормальную концентрацию уксусной кислоты. 204. Рассчитать процентное содержание карбоната натрия в растворе с плотностью 1,05 г/см3, если на титрование аликвоты 20 мл по метиловому оранжевому израсходовали 33,45 мл 0,57 н. раствора соляной кислоты. 205. Рассчитать концентрацию серной кислоты в г/л, если на титрование аликвоты 10 мл израсходовали 20,60 мл 1,01 н. раствора едкого натра. 206. Навеску массой 0,5 г смеси карбонатов натрия и калия растворили в мерной колбе на 100 мл. На нейтрализацию аликвоты объёмом 10 мл по метиловому оранжевому израсходовали 3,95 мл 0,2 н. раствора соляной кислоты. Вычислить процентное содержание карбоната натрия в смеси. 207. Навеску массой 4,0 г нитрата аммония растворили в мерной колбе на 500 мл. К аликвоте 25 мл добавили 10 мл раствора формалина. На титрование азотной кислоты, выделившейся при взаимодействии нитрата аммония с формалином, израсходовали 24,25 мл 0,1 н. раствора едкого натра. Влажность нитрата аммония 2,2 %. Вычислить процентное содержание NH4NO3 и азота в нитрате аммония в пересчёте на сухое вещество. 208. На титрование аликвоты ортофосфорной кислоты объёмом 10 мл израсходовали 8,2 мл 0,1 н. раствора щёлочи. Вычислить молярную концентрацию кислоты в пробе, если титрование вели до перехода окраски фенолфталеина из бесцветной в малиновую.
209. На титрование аликвоты серной кислоты объёмом 10 мл израсходовали 13,4 мл 0,1 н. раствора щёлочи. Вычислить молярную концентрацию кислоты. 210. На титрование аликвоты гидроксида бария объёмом 10 мл израсходовали 24,6 мл 0,1 н. раствора соляной кислоты. Вычислить молярную концентрацию Ba(OH)2. 211. На титрование аликвоты раствора карбоната натрия объёмом 10 мл израсходовали 14,2 мл 0,1 н. раствора серной кислоты. Вычислить нормальную и молярную концентрации карбоната натрия, если титрование вели до обесцвечивания розовой окраски фенолфталеина. 212. На титрование аликвоты раствора сульфата никеля (II) объемом 10 мл израсходовали 12,4 мл 0,05 М раствора трилона Б. Вычислить нормальную концентрацию сульфата никеля. 213. Сколько миллилитров раствора трилона Б с концентрацией 0,05 М будет израсходовано на титрование аликвоты объемом 10 мл раствора с концентрацией по сульфату цинка 0,14 н. и по хлориду меди (II) 0,08 М? 214. Какая масса карбоната натрия (мг) содержится в растворе, если на его нейтрализацию до угольной кислоты расходуется 23,0 мл раствора соляной кислоты концентрацией 0,1020 экв./л? 215. Вычислить массовую долю оксида азота (V) в азотной кислоте, если на титрование пробы HNO3 массой 2,0500 г затрачено 22,7 мл раствора гидроксида натрия концентрацией 0,1 экв./л 216. На титрование навески концентрированной соляной кислоты массой 3,2040 г расходуется 33,05 мл раствора гидроксида натрия концентрацией 1,010 экв./л. Вычислить массовую долю соляной кислоты в растворе. Удовлетворяет ли полученное значение ГОСТ, согласно которому содержание HCl в товарной соляной кислоте должно быть 35-38 %? 217. Для определения свободного Р2О5 в суперфосфате его навеску массой 10,00 г взболтали с водой, отфильтровали и довели дистиллированной водой до 500 мл. От полученного раствора была отобрана аликвота 50 мл. На титрование аликвоты с метиловым оранжевым пошло 16,2 мл раствора гидроксида натрия концентрацией 0,1002 экв./л. Вычислить массовую долю свободного оксида фосфора (V) в суперфосфате. 218. Вычислить массовую долю серной кислоты в растворе, если на титрование аликвоты 10 мл расходуется 20,60 мл раствора гидроксида натрия концентрацией 1,010 экв./л. При расчете плотность раствора кислоты принять равной 1 г/см3. 219. Исследуемое вещество может быть либо гидроксид калия либо гидроксид натрия. Для нейтрализации 1,10 г этого вещества потребовалось 31,4 мл раствора соляной кислоты концентрацией 0,860 экв./л. Определить эквивалентную массу щелочи и установить, гидроксид какого металла содержался в пробе. Вычислить массовую долю примесей в реактиве, считая, что они с соляной кислотой не взаимодействуют. 220. На нейтрализацию 0,2000 г одноосновной органической кислоты потребовалось 31,7 мл раствора гидроксида калия концентрацией 0,1000 экв./л. Вычислить эквивалентную массу кислоты и предложить ее формулу. Фотометрический анализ
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 1484; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.64.128 (0.006 с.) |

 экв/л.
экв/л.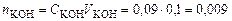 моль.
моль.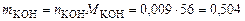 г.
г.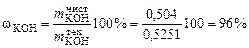 .
.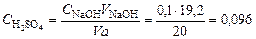 экв/л.
экв/л.


