Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Двухкомпонентные диаграммы состояния жидкость-газ
Краткие теоретические сведения Общая информация Неконденсированные системы изучают с помощью как изобарических сечений диаграмм их состояния (в координатах температура и состав), так и изотермических сечений в координатах давление - состав. В уравнении, определяющем число степеней свободы системы по правилу фаз Гиббса, число внешних переменных уменьшается до единицы Типовые диаграммы состояния
Рис. 1. Диаграмма с неограниченной растворимостью компонентов, без точек азеотропа
Рис. 2. Диаграмма с неограниченной растворимостью компонентов и нижним азеотропом
Рис. 3. Диаграмма с областями полной и частичной растворимостью жидкостей
Рис. 4. Диаграмма с ограниченной растворимостью компонентов, полной растворимости нет
Порядок рассмотрения диаграммы 1. Перечертить диаграмму, соблюдая топологию, в заданном масштабе. 2. Дать общую характеристику диаграммы. 3. Отметить линию газа, линию жидкости, линии растворимости компонентов; написать равновесия на линиях.
4. Обозначить поля диаграммы греческими или римскими цифрами. 5. Указать фазовый состав полей диаграммы. 6. Описать значимые точки диаграммы (точки кипения компонентов, точки азеотропа, точки Алексеева): указать температуру, состав, уравнение равновесия. 7. Рассмотреть свойства систем, заданных соответствующими фигуративными точками и заполнить таблицу
Примеры решения задач Пример 21. Обозначить поля диаграммы (рис. 5), дать характеристику компонентов системы. Описать путь конденсации системы, содержащей 45 % компонента В (точка М), заполнить таблицу.
Рис. 5. Диаграмма состояния системы пентан – гептан. Решение. 1. Пронумеровать поля диаграммы (обычно – римскими цифрами). 2. Дать наименование полей диаграммы. Поле I – газ (пар); поле II – пар + жидкость; поле III – жидкость. 3. Дать характеристику диаграммы. Двухкомпонентная неконденсированная система с неограниченной растворимостью компонентов в жидкой фазе. 4. Путь конденсации системы – вертикальная пунктирная линия вниз от точки М (рис. 6), на которой отмечены фигуративные точки М ', М '', М ''', соответствующие началу процесса (М '), образованию двухфазной системы (М '') и окончанию конденсации (М ''').
Рис. 6. Решение примера 1.
5. Таблица
6. Определить состав системы в точке М, для чего следует опустить перпендикуляр от точки М на ось составов. Состав точки М – 45 % гептана C7H16 – компонента В. Он же будет общим составом системы для всех остальных точек. Точка М находится в поле I, следовательно, число фаз – 1 шт. Наименование фазы – пар; состав совпадает с общим составом системы.
7. Температуру начала конденсации определить по месту пересечения перпендикуляра из точки М и линии газа (граничной линии между полем I и II) – точка М '. От точки М ' провести горизонталь на ось температур. Температура начала конденсации равна 78°С. Она остается одинаковой для всех рассматриваемых точек. 8. Определить число степеней свободы в точке М:
9. Определить фазовый состав в точке М '. Точка М ' находится на линии конденсации, следовательно, количество фаз – 2 шт.: газ и жидкость. 10. Определить состав жидкости в точке М ', для чего от этой точки провести ноду до пересечения с линией жидкости (или линией испарения) и от точки пересечения опустить перпендикуляр на ось составов (позиция Ж М' на рис. 6). Состав жидкости – 82 % C7H16. 11. Определить относительное количество фаз в точке М ': так как М ' находится на линии равновесия между двумя фазами, то относительное их количество не определяется. В такой ситуации следует записать уравнение равновесия. В данном случае – Ж = Г. 12. Определить число степеней свободы в точке М ':
13. Определить фазовый состав точки М '', которая находится в поле II, следовательно, число фаз – 2 шт.: жидкость и газ. 14. Определить состав жидкости и газа в точке М '': провести ноду до пересечения с линий испарения (точка X) с одной стороны и с линией конденсации (точка Y) с другой стороны. От точек пересечения опустить перпендикуляры на ось составов. Перпендикуляр от линии конденсации определяет состав газа (27 % гептана – точка Г М '' на рис. 6), от линии испарения – состав жидкой фазы (69 % гептана – точка Ж М '' на рис. 6). 15. Определить относительное количество фаз в точке М ''. В соответствии с правилом рычага
16. Определить число степеней свободы в точке М '':
17. Температуру завершения процесса конденсации определить по месту пересечения перпендикуляра из точки М с линией испарения – точка М '''. От точки М ''' провести горизонталь на ось температур. Температура завершения конденсации равна 51°С. Она остается одинаковой для всех рассматриваемых точек. 18. Определить фазовый состав в точке М '''. Точка М ''' находится на линии испарения, следовательно, количество фаз – 2 шт.: газ и жидкость. 19. Определить состав пара в точке М ''', для этого от этой точки провести ноду до пересечения с линией конденсации и от этой точки опустить перпендикуляр на ось составов (позиция Г М ''' на рис. 6). Состав пара – 13 % C7H16. 20. Определить относительное количество фаз в точке М ''': так как М ''' находится на линии равновесия между двумя фазами, то относительное их количество не определяется. В такой ситуации следует записать уравнение равновесия. В данном случае – Ж = Г. 21. Определить число степеней свободы в точке М ''':
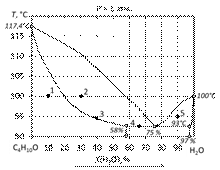
Пример 22. Обозначить поля диаграммы (рис. 7), дать характеристику компонентов системы. Определить изменение состава и количества фаз в системе, содержащей 25 % анилина при охлаждении ее от 170 до 60°С с интервалом 40°С. Нанести на диаграмму соответствующие фигуративные точки систем и фаз, заполнить таблицу.
Рис. 7. Диаграмма состояния вода – этаноламин. Решение. 1. Пронумеровать поля диаграммы (обычно – римскими цифрами). 2. Дать наименование полей диаграммы: поле I – жидкость (пар); поле II – область расслоения двух жидкостей.
3. Дать характеристику диаграммы: двухкомпонентная неконденсированная система с ограниченной растворимостью компонентов в жидкой фазе. 4. Отметить исследуемый состав системы, соответствующий содержанию анилина C2H5NH2 25 % и отметить фигуративные точки N, N ', N '', соответствующие заданному температурному интервалу.
Рис. 8. Решение примера 2. 5. Определить фазовый состав в каждой точке. Точка N принадлежит к полю I, следовательно, количество фаз – 1 шт. – жидкость, содержащая 25 % анилина. Точки N ' и N '' принадлежат полю II, где происходит расслаивание системы на две жидкости разного состава, следовательно, количество фаз – 2 шт. Состав жидкостей зависит от температуры. 6. Определить состав расслаивающихся жидкостей в точках N ' и N '', как показано на рис. 8 и зафиксировано в табл. 2. При этом следует учитывать, что жидкость 1 представляет насыщенный раствор анилина в воде, а жидкость 2 – раствор воды в анилине. Соответственно точки X и P отображают состав Ж1, а точки Y и R – состав жидкости 2. 7. Пользуясь правилом рычага, определить относительное количество каждой фазы. Для точки N ': Для точки N '':
Задачи для решения 8.3.1. Расшифровать диаграмму состояния «жидкость-газ», как в примере 21. 141.
Рис. 9. Диаграмма состояния вода – азотная кислота. 142.
Рис. 10. Диаграмма состояния уксусная кислота – азотная кислота. 143.
Рис. 11. Диаграмма состояния вода – фтороводород.
144.
Рис. 12. Диаграмма состояния фурфурол-вода. 145.
Рис. 13. Диаграмма состояния бутанол-1 – вода. 146.
Рис. 14. Диаграмма состояния изобутиловый спирт – вода. 147.
Рис. 15. Диаграмма состояния пентанол-вода
148.
Рис. 16. Диаграмма состояния метил-ацетат – сероуглерод. 149.
Рис. 17. Диаграмма состояния четырёххлористый углерод – метанол. 150.
Рис. 18. Диаграмма состояния бензол – метанол, полученная при давлении 0,9 атм. 151.
Рис. 19. Диаграмма состояния бензол – метанол.
152.
Рис. 20. Диаграмма состояния бензол – диметиловый эфир 153.
Рис. 21. Диаграмма состояния метанол – диметиловый эфир. 154.
Рис. 22. Диаграмма состояния хлороформ – метилацетат. 155.
Рис. 23. Диаграмма состояния хлороформ – метилацетат.
156.
Рис. 24. Диаграмма состояния вода – пропанол-1. 157.
Рис. 25. Диаграмма состояния бутилацетат – диэтиловый эфир. 158.
Рис. 26. Диаграмма состояния бутилацетат – диэтиловый эфир. 159.
Рис. 27. Диаграмма состояния бутилацетат – диэтиловый эфир. 160.
Рис. 28. Диаграмма состояния метанол – хлороформ.
8.3.2. Расшифровать диаграмму состояния «жидкость-жидкость», как в примере 22. 161. Определить изменение состава и количества фаз в системе (точка 1, рис. 29) при охлаждении от 160 до 40 °С с интервалом 40 °С. 162. Определить изменение состава и количества фаз в системе (точка 2, рис. 29) при охлаждении от 160 до 40 °С с интервалом 40 °С.
Рис. 29. Диаграмма состояния вода – 2,6-диметилпиридин. 163. Определить изменение состава и количества фаз в системе (точка 1, рис. 30) при охлаждении от 120 до 0 °С с интервалом 40 °С. 164. Определить изменение состава и количества фаз в системе (точка 2, рис. 30) при охлаждении от 120 до 0 °С с интервалом 40 °С.
Рис. 30. Диаграмма состояния вода – 2,4,6-триметилпиридин. 165. Определить изменение состава и количества фаз в системе (точка 1, рис. 31) при охлаждении от 120 до 0 °С с интервалом 40 °С. 166. Определить изменение состава и количества фаз в системе (точка 2, рис. 31) при охлаждении от 120 до 0 °С с интервалом 40 °С.
Рис. 31. Диаграмма состояния фенол – вода. 167. Определить изменение состава и количества фаз в системе (точка 1, рис. 32) при охлаждении от 140 до 40 °С с интервалом 20 °С. 168. Определить изменение состава и количества фаз в системе (точка 2, рис. 32) при охлаждении от 140 до 40 °С с интервалом 20 °С.
Рис. 32. Диаграмма состояния никотин – вода. 169. Определить изменение состава и количества фаз в системе (точка 1, рис. 33) при охлаждении от 160 до 40 °С с интервалом 40 °С. 170. Определить изменение состава и количества фаз в системе (точка 2, рис. 33) при охлаждении от 160 до 40 °С с интервалом 40 °С.
Рис. 33. Диаграмма состояния вода – анилин. 171. Определить изменение состава и количества фаз в системе (точка 1, рис. 34) при охлаждении от 600 до 400 °С с интервалом 50 °С. 172. Определить изменение состава и количества фаз в системе (точка 2, рис. 34) при охлаждении от 600 до 400 °С с интервалом 50 °С.
Рис. 34. Диаграмма состояния галлий – таллий. 173. Определить изменение состава и количества фаз в системе (точка 1, рис. 35) при охлаждении от 2800 до 2300 °С с интервалом 100 °С. 174. Определить изменение состава и количества фаз в системе (точка 2, рис. 35) при охлаждении от 2800 до 2300 °С с интервалом 100 °С.
Рис. 35. Диаграмма состояния иттрий – ванадий. 175. Определить изменение состава и количества фаз в системе (точка 1, рис. 36) при охлаждении от 2300 до 1700 °С с интервалом 100 °С. 176. Определить изменение состава и количества фаз в системе (точка 2, рис. 36) при охлаждении от 2300 до 1700 °С с интервалом 100 °С.
Рис. 36. Диаграмма состояния хром – свинец.
177. Определить изменение состава и количества фаз в системе (точка 1, рис. 37) при охлаждении от 600 до 400 °С с интервалом 100 °С. 178. Определить изменение состава и количества фаз в системе (точка 2, рис. 37) при охлаждении от 600 до 400 °С с интервалом 100 °С.
Рис. 37. Диаграмма состояния галлий – свинец. 179. Определить изменение состава и количества фаз в системе (точка 1, рис. 38) при охлаждении от 1050 до 850 °С с интервалом 50 °С. 180. Определить изменение состава и количества фаз в системе (точка 2, рис. 38) при охлаждении от 1050 до 850 °С с интервалом 50 °С.
Рис. 38. Диаграмма состояния алюминий – висмут.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 1229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.248.20 (0.102 с.) |
 . Максимальное число фаз, находящихся в равновесии в таких системах, не превышает трех, системы с двумя фазами имеют одну степень свободы, а с одной - две степени свободы.
. Максимальное число фаз, находящихся в равновесии в таких системах, не превышает трех, системы с двумя фазами имеют одну степень свободы, а с одной - две степени свободы.








 .
. .
. 45%;
45%;  55 %.
55 %.

 80 %;
80 %;  20 %.
20 %. 75 %;
75 %;  25 %.
25 %.