
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соль образована слабым основанием и сильной кислотой
Гидролизуется катион слабого основания:
В растворе появляются ионы Н+, поэтому среда кислая, рН<7. Концентрация катионов водорода вычисляется по уравнению:
где Сi – моляльная концентрация гидролизующегося иона. Если в реакции гидролиза участвует катион слабого растворимого основания, то для вычисления константы гидролиза используют константу диссоциации слабого основания. Например, для расчета константы гидролиза для
используют константу диссоциации гидроксида аммония. Если в реакции гидролиза участвует катион нерастворимого гидроксида металла, то для вычисления константы гидролиза используют константу нестойкости гидроксокомплекса. Например, если в реакции гидролиза участвует катион меди (II)
Для вычисления константы гидролиза используют значение константы нестойкости гидроксокомплекса Примеры решения задач Пример 15. Вычислить рН раствора сульфата аммония концентрацией 3 % при 25°С; Решение. 1. Вычислить моляльную концентрацию сульфата аммония
2. Составить ионное уравнение гидролиза сульфата аммония:
3. Вычислить константу гидролиза
4. Вычислить концентрацию катионов водорода
5. Вычислить рН раствора
Пример 16. Вычислить рН раствора, содержащего массовую долю сульфата никеля (II) 6 %, плотностью 1,063 г/см3; константа нестойкости катиона гидроксоникеля 2,51·10-5. Решение. 1. Вычислить моляльную концентрацию сульфата никеля (II)
2. Составить ионное уравнение гидролиза сульфата никеля (II):
3. Вычислить константу гидролиза
4. Вычислить концентрацию катионов водорода
5. Вычислить рН раствора
Пример 17. Вычислить рН раствора гидрокарбоната калия концентрацией 63,2 г/л плотностью 1,0529 г/см3; для угольной кислоты Решение. 1. Вычислить моляльную концентрацию гидрокарбоната калия. Для этого рассчитать массовую долю гидрокарбоната калия в растворе:
и вычислить моляльную концентрацию раствора:
2. Составить ионное уравнение гидролиза:
3. Вычислить константу гидролиза
4. Вычислить концентрацию гидроксил-ионов
5. Вычислить рН раствора
Пример 18. Вычислить рН раствора сульфита натрия концентрацией 6 %; для сернистой кислоты Решение. 1. Вычислить моляльную концентрацию сульфита натрия:
2. Составить ионное уравнение гидролиза:
3. Вычислить константу гидролиза
4. Вычислить концентрацию гидроксил-ионов
5. Вычислить рН раствора
Задачи для решения Вычислить рН раствора гидролизующейся соли
Буферные растворы Основные уравнения Буферными называют растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Различают следующие кислые и основные буферные растворы. К кислым буферным растворам относятся: 1. Смесь слабой кислоты и ее соли, например, СН3СООН + CH3COONa. 2. Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты, например, Na2CO3 + NaHCO3, Na3PO4 + NaHPO4 или Na2HPO4 + NaH2PO4. рН таких раствора вычисляется по уравнению
3. Кислые соли слабых многоосновных кислот, например, NaHCO3:
Основной буферный раствор образован слабым основанием и его солью, например, NH4OH + NH4Cl. рН основного буферного раствора вычисляется по уравнению:
где Примеры решения задач Пример 19. К 0,8 л 0,5 М раствора НСООН (K d = 1,77×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера. Решение. 1. Вычислить количество вещества НСООН и NaOH:
Объем буферного раствора V равен:
Определить количество вещества формиата натрия, образующегося по реакции: NaOH + HCOOH = HCOONa + H2O:
Найти молярную концентрацию формиата натрия в буферном растворе:
Найти остаточное количество вещества муравьиной кислоты:
и ее молярную концентрацию в буферном растворе
Определить рН буферного раствора
Пример 20. Вычислить рН ацетатного буферного раствора, полученного при смешивании 400 мл раствора с массовой долей уксусной кислоты ( Решение. 1. Рассчитать массу раствора уксусной кислоты
2. Рассчитать массу уксусной кислоты
3. Рассчитать количество вещества уксусной кислоты
4. Рассчитать массу гидроксида бария
5. Рассчитать количество вещества гидроксида бария
6. Составить уравнение реакции:
7. Из уравнения реакции следует, что 8. Составить баланс реакции (образование воды можно не учитывать):
Образуется буферная смесь, состоящая из уксусной кислоты и ацетата бария. 10. Вычислить p Kd уксусной кислоты:
11. Вычислить рН буферного раствора по формуле:
Задачи для решения 121. Вычислить рН ацетатного буферного раствора, полученного при смешивании 200 мл раствора уксусной кислоты концентрацией 0,5 экв./л и 10 мл раствора гидроксида натрия концентрацией 0,8 экв./л; 122. Вычислить рН аммиачно-хлоридного буферного раствора, полученного при смешивании 75 мл раствора с массовой долей гидроксида аммония 2 % плотностью 0,989 г/см3 и 25 мл раствора с массовой долей соляной кислоты 4 % плотностью 1,018 г/см3; 123. Вычислить рН фосфатного буферного раствора, полученного при смешивании 15 м3 раствора с массовой долей ортофосфорной кислоты 5 % плотностью 1,026 г/см3 и раствора с массовой долей гидроксида натрия 2 % плотностью 1,020 г/см3; 124. Вычислить рН аммиачно-сульфатного буферного раствора, полученного при смешивании 5 л раствора с массовой долей гидроксида аммония 5 % плотностью 0,977 г/см3 и 10 л раствора с массовой долей серной кислоты 3 % плотностью 1,019 г/см3; 125. Вычислить рН фосфатного буферного раствора, состоящего из ортофосфорной кислоты и дигидроортофосфата натрия, полученного при смешивании 713 мл раствора с массовой долей ортофосфорной кислоты 6 % плотностью 1,031 г/см3 и 240 мл раствора с массовой долей гидроксида натрия 4 % плотностью 1,043 г/см3; 126. Вычислить рН аммиачно-хлоридного буферного раствора, полученного при смешивании 10 л раствора гидроксида натрия концентрацией 8 г/л и 12,5 л раствора гидроксида аммония концентрацией 10,7 г/л;
127. Вычислить рН аммиачно-хлоридного буферного раствора, полученного при смешивании 1 л раствора, содержащего массовую долю гидроксида аммония 10 % плотностью 0,957 г/см3 и 350 мл раствора, содержащего массовую долю соляной кислоты 10 % плотностью 1,048 г/см3; 128. Вычислить рН карбонатного буферного раствора, полученного при смешивании 500 мл раствора гидрокарбоната натрия концентрацией 10 г/л и 200 мл раствора гидроксида натрия концентрацией 2 г/л; 129. Вычислить рН гидрокарбонатного буферного раствора, полученного при смешивании 50 мл раствора гидрокарбоната натрия концентрацией 8,4 г/л и 35 мл раствора соляной кислоты концентрацией 4 г/л; 130. Вычислить рН аммиачно-сульфатного буферного раствора, полученного при смешивании 500 мл раствора сульфата аммония концентрацией 26 г/л и 500 мл раствора гидроксида натрия концентрацией 8 г/л; 131. Вычислить рН фосфатного буферного раствора, полученного при смешивании 500 мл раствора с массовой долей ортофосфорной кислоты 4 % плотностью 1,020 г/см3 и 100 мл раствора с массовой долей гидроксида калия 5 % плотностью 1,040 г/см3; 132. Вычислить рН карбонатного буферного раствора, полученного при смешивании 170 мл раствора гидрокарбоната натрия концентрацией 40 г/л и 30 мл раствора, содержащего массовую долю серной кислоты 6 % плотностью 1,038 г/см3; 133. Вычислить рН аммиачно-сульфатного буферного раствора, полученного при смешивании 50 мл раствора, содержащего массовую долю гидроксида аммония 16 % плотностью 0,936 г/см3 и 70 мл раствора, содержащего массовую долю серной кислоты 10 % плотностью 1,066 г/см3; 134. Вычислить рН карбонатного буферного раствора, полученного при смешивании 10 л гидрокарбоната калия концентрацией 2,15 г/л и 1,1 л раствора, содержащего массовую долю гидроксида калия 1 % плотностью 1,007 г/см3; 135. Вычислить рН карбонатного буферного раствора, полученного при смешивании 5 л раствора гидрокарбоната натрия концентрацией 3,36 г/л и 97 мл раствора, содержащего массовую долю серной кислоты 2 % плотностью 1,012 г/см3; 136. Вычислить рН фосфатного буферного раствора, полученного при смешивании 4 л раствора гидроортофосфата калия концентрацией 2,175 г/л и 1 л раствора гидроксида калия концентрацией 2,24 г/л; 137. Вычислить рН фосфатного буферного раствора, полученного при смешивании 2 л раствора дигидроортофосфата калия концентрацией 3,4 г/л и 0,5 л раствора гидроксида калия концентрацией 4,48 г/л; 138. Вычислить рН сульфитного буферного раствора, полученного при смешивании 2 л раствора сульфита натрия концентрацией 7,56 г/л и 36 мл раствора, содержащего массовую долю соляной кислоты 2 % плотностью 1,008 г/см3;
139. Вычислить рН сульфитного буферного раствора, полученного при смешивании 5 л раствора гидросульфита натрия концентрацией 4,16 г/л и 350 мл раствора, содержащего массовую долю гидроксида натрия 2 % плотностью 1,020 г/см3; 140. Вычислить рН сульфитного буферного раствора, полученного при смешивании 4 л раствора сернистой кислоты концентрацией 4,1 г/л и 700 мл раствора, содержащего массовую долю гидроксида натрия 1 % плотностью 1,009 г/см3;
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 233; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.208.72 (0.044 с.) |
 .
.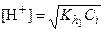 .
. - катиона слабого основания гидроксида аммония NH4OH - по реакции
- катиона слабого основания гидроксида аммония NH4OH - по реакции ,
,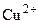 - катион слабого нерастворимого основания Cu(OH)2, то реакции гидролиза по первой ступени соответствует уравнение реакции:
- катион слабого нерастворимого основания Cu(OH)2, то реакции гидролиза по первой ступени соответствует уравнение реакции: .
. .
. .
.
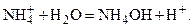


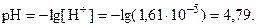





 ,
,  .
.
 .
.


 .
. ,
,  .
. .
.


 .
. ,
, - концентрация соли, моль/л;
- концентрация соли, моль/л;  - концентрация кислоты, моль/л. В качестве соли в п. 2 принимают среднюю (Na2CO3, Na3PO4) или менее кислую (Na2HPO4) соль. В качестве кислоты принимают собственно кислоту или более кислую (NaH2PO4, NaHPO4) соль.
- концентрация кислоты, моль/л. В качестве соли в п. 2 принимают среднюю (Na2CO3, Na3PO4) или менее кислую (Na2HPO4) соль. В качестве кислоты принимают собственно кислоту или более кислую (NaH2PO4, NaHPO4) соль. - отрицательный логарифм константы диссоциации слабой кислоты. Номер константы диссоциации выбирается по составу буферного раствора. Например, для Na2CO3 + NaHCO3 следует использовать
- отрицательный логарифм константы диссоциации слабой кислоты. Номер константы диссоциации выбирается по составу буферного раствора. Например, для Na2CO3 + NaHCO3 следует использовать  угольной кислоты, а для Na3PO4 + NaHPO4 -
угольной кислоты, а для Na3PO4 + NaHPO4 - 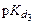 для фосфорной кислоты.
для фосфорной кислоты.

 - отрицательный логарифм константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л.
- отрицательный логарифм константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л.
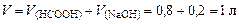
 моль.
моль. моль/л.
моль/л.
 моль/л.
моль/л.
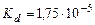 ) 4 % (плотность 1,004 г/см3) и 300 мл раствора гидроксида бария концентрацией 43 г/л.
) 4 % (плотность 1,004 г/см3) и 300 мл раствора гидроксида бария концентрацией 43 г/л. .
. .
. .
. .
.
 .
. и
и  .
.


 .
.

 .
. ;
;  .
. .
. .
. .
.


