
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесия в насыщенных растворах. Расчет растворимости
Основные уравнения Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Растворимость соли в бинарной системе соль - вода соответствует ее концентрации в насыщенном растворе, т.е.
при растворении 1 моль соли образуется х моль катионов металла и у моль анионов кислотного остатка:
Уравнение закона действующих масс можно записать в следующем виде:
из которого следует уравнение расчета растворимости:
Если раствор содержит, помимо трудно растворимой соли, хорошо растворимую соль, имеющий в своем составе одноименные с составом осадка ионы, например: В присутствии одноименного аниона
Например, уравнение закона действующих масс для системы
В присутствии одноименного катиона
Например, уравнение закона действующих масс для системы
В обоих случаях приходится решать степенное уравнение второго или более высокого порядка. Растворимость осадка труднорастворимой соли слабой кислоты зависит от рН раствора из-за частичного или даже полного ее растворения в более сильной кислоте. Для соли слабой одноосновной кислоты взаимодействие с сильной кислотой протекает по уравнению:
Растворимости соли
для которого произведение растворимости
Если за растворимость принять концентрацию катионов металла, то
Для слабой одноосновной кислоты
Для слабой двухосновной кислоты типа H2R
Примеры решения задач Пример 7. Рассчитать растворимость Ag2SO4 в воде при 25°С; Решение. 1. Составить уравнение растворимости Ag2SO4:
из которого следует, что
2. Составить формулу произведения растворимости Ag2SO4:
3. Вычислить значение растворимости Ag2SO4
Пример 8. Вычислить растворимость сульфата серебра в растворе сульфата натрия концентрацией 31 г/л (плотность 1,025 г/см3);
Решение. 1. Рассчитать моляльную концентрацию раствора сульфата натрия. Для этого перейти к массовой концентрации по формуле
и вычислить моляльную концентрацию:
2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
откуда
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными. Пример 9. Вычислить растворимость сульфата серебра в растворе, содержащем массовую долю нитрата серебра 3 %; Решение. 1. Рассчитать моляльную концентрацию нитрата серебра в растворе по формуле
2. Составить уравнение диссоциации нитрата серебра:
из которого следует, что концентрация иона серебра
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем нитрат серебра и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
где
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными.
Пример 10. Вычислить растворимость сульфата свинца в воде; Решение. 1. Составить уравнение растворимости сульфата свинца:
из которого следует, что
2. Составить формулу произведения растворимости:
3. Рассчитать растворимость сульфата свинца в воде:
Пример 11. Вычислить растворимость сульфата свинца в растворе сульфата натрия концентрацией 0,03 г/л; Решение. 1. Рассчитать моляльную концентрацию сульфата натрия. В данном случае можно воспользоваться формулой:
т.к. величина молярной концентрации не превышает 0,01 моль/л. 2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
где
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными. Пример 12. Рассчитать растворимость сульфата свинца в растворе нитрата свинца концентрацией 0,062 моль/кг. Решение. Составить уравнение диссоциации нитрата свинца:
из которого следует, что концентрация ионов свинца
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат синца и нитрат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона
следовательно, величиной S 2 в формуле произведения растворимости нитрата свинца можно пренебречь:
7. Вычислить растворимость сульфата свинца в растворе нитрата свинца по формуле
Пример 13. Во сколько раз растворимость фторида бария в 0,01 М растворе соляной кислоты больше растворимости в чистой воде? Решение. 1. Составить уравнение растворимости фторида бария:
из которого следует, что
2. Выразить концентрацию фторидных ионов с учетом кислотности раствора:
3. Составить уравнение произведения растворимости:
4. Вычислить растворимость соли в воде
5. Вычислить растворимость соли в присутствии соляной кислоты
Пример 14. Во сколько раз растворимость оксалата кальция в растворе с рН = 3,3 больше его растворимости в воде? Решение. 1. Составить уравнение растворимости оксалата кальция:
2. Из уравнения растворимости следует, что
3. Вычислить концентрацию катионов водорода в растворе
4. Выразить концентрацию оксалат-ионов с учетом кислотности раствора
5. Составить уравнение произведения растворимости оксалата кальция
6. Вычислить растворимость оксалата кальция в воде
7. Вычислить растворимость оксалата кальция в растворе с рН = 3,3
8. Растворимость в кислом растворе в 3,3 раза больше, чем в воде. Задачи для решения 5.3.1 Вычислить растворимость предложенного малорастворимого соединения в воде и в растворе соли, содержащей одноименный ион при 25°С
5.3.2 Вычислить растворимость осадка в воде и в кислом растворе при 25°С
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 504; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.148.124 (0.078 с.) |
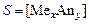 . Согласно уравнению растворимости:
. Согласно уравнению растворимости:
 и
и  .
. ,
, .
.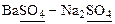 или
или  , то при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников.
, то при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников. уравнение закона действующих масс
уравнение закона действующих масс .
. :
:

 .
. :
: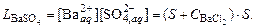
 .
. соответствует уравнение
соответствует уравнение ,
, .
. .
.
 вычисляют по уравнениям:
вычисляют по уравнениям: при
при  ;
; при
при  .
.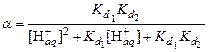 при
при  при
при  .
. ,
, .
. .
. моль/кг.
моль/кг.

 ,
,
 ;
;  .
.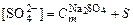
 .
. :
: ,
, ,
,

 ,
,
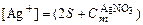 ;
; 
 .
. :
: ,
, ,
, ,
, ;
;  ;
; 
 ;
; ;
; моль/кг.
моль/кг. .
. ,
, ;
;  .
. .
. моль/кг.
моль/кг.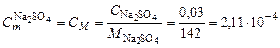 моль/кг,
моль/кг, ;
;  .
. ,
, ,
,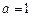 ;
;  ;
; 
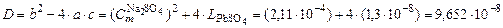 ;
; ;
;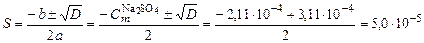 моль/кг.
моль/кг. ,
, .
.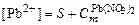 ;
;  .
.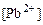 :
: ,
,
 .
. ,
,  .
. ,
, ;
;  .
.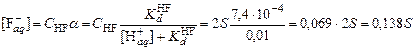
 .
. ;
; .
.
 .
.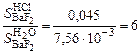 .
. ;
;  ,
,  .
. .
. ,
, 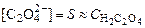 .
.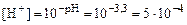 .
.
 .
. .
. ;
; .
.


