
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекции, Практические и лабораторные занятияСтр 1 из 8Следующая ⇒
Магистр 1. Общие требования к самостоятельной работе 1.1. Цели и задачи дисциплины Основной целью изучения дисциплины «Физико-химические методы исследования материалов, реагентов и углеводородных систем» является приобретение студентами знаний в области физико-химических методов анализа углей, нефти и нефтепродуктов, газа; углубленное изучение теоретических основ и получение практических навыков в проведении аналитических работ. Задача дисциплины в том, чтобы на основании полученных знаний студент, будущий специалист знаком с приборами и методами исследования состава и свойств сырья, промежуточных веществ и продуктов его переработки в лабораторных и промышленных условиях. 1.2. Место дисциплины в структуре ООП Д исциплина «Физико-химические методы исследования материалов, реагентов и углеводородных систем» относится к циклу математических и естественнонаучных дисциплин. Для изучения дисциплины студент должен обладать знаниями по предмету «Химия», «Химия нефти и газа», устанавливаемыми ФГОС ВПО по направления подготовки 131000. 1.3. Требования к результатам освоения дисциплины Процесс изучения дисциплины направлен на формирование следующих общекультурных компетенций: готовностью обобщать, анализировать, воспринимать информацию, ставить цели и выбирать пути ее достижения (ОК-1); способностью логически верно, аргументировано и ясно строить устную и письменную речь (ОК-3); стремлением к саморазвитию, повышению своей квалификации и мастерства (ОК-9); умением критически оценивать свои личностные качества, нахождением путей и выбора средств развития достоинств и устранения недостатков (ОК-10). профессиональных компетенций: готовностью проводить самостоятельно или в составе группы научный поиск, реализуя специальные средства и методы получения нового знания (ПК-6); применяет основные методы, способы и средства получения, хранения и обработки информации, навыки работы с компьютером как средством управления информацией (ПК-8); умением подготавливать данные для составления обзоров, отчетов и научных публикаций (ПК-25). В результате изучения дисциплины студент должен: знать теоретические основы, лежащие в основе методов анализа; основные понятия, связанные со способами анализа;
уметь грамотно обработать результаты измерений с определением погрешностей и их источников; спланировать аналитический контроль технологического процесса, исходных, промежуточных и конечных продуктов. владеть методами установления состава структуры и свойств природных энергоносителей; приборной базой – отечественной и импортной, правилами и порядком проведения аналитических исследований Содержание дисциплины распределяется между лекционной и практической частями на основе принципа дополнительности: лекции, практические и лабораторные занятия не дублируют друг друга. Согласно рабочей программе дисциплины на самостоятельную работу студентам выделяется 144 часа. В течение этого времени студенты самостоятельно изучают учебную, научную и периодическую литературу. Они имеют возможность обсудить прочитанное с преподавателем дисциплины во время плановых консультаций, с другими студентами во время практических занятий, а также на лекциях, задавая уточняющие вопросы лектору. Студентам необходимо готовиться к каждой лекции и практическому занятию. Итоговая форма контроля учебной дисциплины – экзамен, к которому допускаются студенты, выполнившие все виды самостоятельной подготовки и отчитавшиеся по ним перед преподавателем. В процессе изучения дисциплины студент должен выполнить 13 домашних заданий. Номер варианта домашнего задания и сроки сдачи определяются преподавателем. График выполнения домашних заданий студент получает у лектора потока в начале семестра. Решения задач должны быть кратко и точно обоснованы. При решении задач следует приводить весь ход решения и математические преобразования. Каждая работа аккуратно оформляется. Для замечаний преподавателя нужно оставить достаточно широкие поля (не менее трех сантиметров). Обязательно дать номер варианта, номер задачи, полное и краткое условия задачи. Задачи приводятся в том порядке, в котором они указаны в задании. Работы должны быть датированы, подписаны студентом и представлены преподавателю для проверки. Если домашняя работа не зачтена, то нужно исправить решение в соответствии с указаниями преподавателя, и подать работу на повторную проверку. Исправления следует выполнять в конце работы под заголовком «Работа над ошибками», указывая номер исправляемого задания.
Лекционные занятия Лекционные занятия определяю направление и темы изучаемого материала. На лекциях кратко излагают основные теоретические сведения и практическое применение законов и закономерностей физической химии применительно к анализу состава и свойств веществ. Лекционные занятия предполагают самостоятельную проработку материала при помощи учебников и иной учебно-методической или научной литературы.
Практические занятия Целью практических занятий ставится приобретение навыков выполнения основных химических расчетов. Для подготовки к практическим занятиям рекомендуется ознакомиться с материалом соответствующего практического занятия по конспектам лекций, учебникам и учебным пособиям. На практические занятия следует приносить конспекты лекций, методические указания для самостоятельной работы, средства вычислительной техники. При изучении дисциплины на практических занятиях рассматриваются следующие темы:
Лабораторный практикум Целью лабораторного практикума ставится приобретение практических навыков организации и выполнения лабораторного эксперимента, обработки его результатов и составления отчета по форме отчета о НИР или научной статьи. Для подготовки к лабораторному практикуму рекомендуется ознакомиться с материалом соответствующей лабораторной работы и теоретическими основами методов. На лабораторные занятия следует приносить методические указания для лабораторных работ, средства вычислительной техники. Дата выполнения лабораторных работ указана в графике лабораторного практикума. Лабораторный практикум выполняют группами численностью от 3 до 5 человек. Состав группы формируется студентами самостоятельно.
Основные уравнения Массовую долю элемента в составе сложного химического соединения вычисляют по формуле:
где z – стехиометрический индекс элемента в формуле химического соединения; Mi – молярная масса искомого элемента, г/моль; Массовую долю элемента в виде оксида в составе сложного химического соединения вычисляют по формуле:
где z – стехиометрический индекс элемента в формуле химического соединения; Используя соотношение молярных масс можно вычислить массу одного вещества по массе другого:
Примеры решения задач Пример 1. Вычислить массовую долю железа и оксида железа (III) в составе гидроксида железа (III). Решение 1. Массовую долю железа в составе его гидроксида вычисляют по формуле:
2. Массовую долю оксида железа (III) в составе его гидроксида вычисляют по формуле:
Пример 2. Вычислить массовую долю алюминия и оксида алюминия в составе его сульфата. Решение 1. Массовую долю алюминия вычисляют по формуле:
2. Массовую долю оксида алюминия вычисляют по формуле:
Пример 3. Какую массу сульфата бария можно получить из 1,2083 г сульфата алюминия?
Задачи для решения 1. Вычислить массовую долю алюминия и оксида алюминия в его сульфате. 2. Вычислить массовую долю натрия и оксида натрия в поваренной соли. 3. Вычислить массовую долю магния и оксида магния в его карбонате. 4. Вычислить массовую долю кальция и оксида кальция в его метасиликате. 5. Вычислить массовую долю железа и оксида железа (III) в пирите (FeS2). 6. Вычислить массовую долю ртути и оксида ртути (II) в сульфиде ртути(II). 7. Вычислить массовую долю олова и оксида олова (II) в касситерите (SnO2). 8. Вычислить массовую долю свинца и оксида свинца (II) в сульфиде свинца (II). 9. Вычислить массовую долю цинка и оксида цинка в его сульфиде. 10. Вычислить массовую долю бериллия и оксида бериллия в его метасиликате. 11. Какую массу (NH4)3PO4×12MoO3 можно получить из 0,1328 г ортофосфата натрия? 12. Какую массу (NH4)3PO4×12MoO3 можно получить из 2,0740 г сульфата аммония? 13. Какую массу сульфата стронция можно получить из 0,0392 г сульфида меди (II)? 14. Какую массу фторида лантана (III) можно получить из 0,8372 г фторида натрия? 15. Какую массу фторида кальция можно получить из 0,9238 г фторида калия? 16. Какую массу карбоната кальция можно получить из 0,1293 г гидрокарбоната натрия? 17. Какую массу оксалата кальция можно получить из 1,3170 г нитрата кальция? 18. Какую массу карбоната серебра можно получить из 1,3170 г карбоната натрия? 19. Какую массу хромата серебра можно получить из 1,3170 г хромата натрия? 20. Какую массу бихромата бария можно получить из 1,3170 г бихромата натрия? Основные уравнения Массовая доля: Массовая концентрация, выраженная в граммах на литр: Молярная концентрация или молярность: Моляльная концентрация или моляльность: Мольная доля: Нормальная концентрация или нормальность: где Для кислот z соответствует основности кислоты, т. е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием. Для оснований z соответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой. Для солей z рассчитывают как произведение числа атомов и степени окисления металла в составе соли. Для окислителей и восстановителей в окислительно-восстановительных реакциях z – изменение их степени окисления в ходе реакции. Некоторые соотношения между различными способами выражения концентрации раствора:
Примеры решения задач Пример 5. Выразить концентрацию раствора, содержащего массовую долю серной кислоты 30 % плотностью 1,218 г/см3 всеми возможными способами. Решение. 1. Рассчитать массовую концентрацию раствора:
2. Рассчитать молярную концентрацию раствора:
3. Рассчитать нормальную концентрацию раствора:
4. Рассчитать моляльную концентрацию раствора:
5. Рассчитать мольную долю растворенного вещества
Пример 6. Какой объем раствора серной кислоты концентрацией 0,42 моль/л потребуется для нейтрализации 20 мл раствора гидроксида калия концентрацией 6 % (d = 1,053 г/см3)? Задачи для решения Выразить концентрацию заданного раствора всеми возможными способами
41. Какова нормальная концентрация раствора соляной кислоты, если на нейтрализацию ее раствора объемом 20 мл израсходовано 10 мл 0,2 н. раствора гидроксида бария? 42. Какой объем 0,5 н. раствора серной кислоты потребуется для осаждения всего бария в виде сульфата из раствора хлорида бария, содержащего 2,3 г бария? 43. Какова молярная концентрация серной кислоты, если на нейтрализацию 75 мл ее раствора было израсходовано 12,5 мл 0,2 н. калиевой щелочи? 44. Какова нормальность раствора нитрата серебра, если для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора, потребовалось 50 мл 0,2 н. раствора соляной кислоты? 45. Какова нормальность серной кислоты, если на нейтрализацию 20 мл ее раствора потребовалось 31 мл 0,16 н. раствора щелочи? 46. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора содержащего 0,32 г гидроксида натрия в 40 мл? 47. Вычислить нормальность кислоты, если на нейтрализацию 50 мл ее раствора потребовалось 14 мл 0,2 н раствора щелочи. 48. Какая масса азотной кислоты содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствора гидроксида натрия? 49. Какой объем 1 н. раствора едкого натра потребуется для полной нейтрализации 300 мл 0,1 М раствора серной кислоты? 50. Какой объем 0,1 н. едкого натра (NaOH) потребуется для осаждения меди в виде гидроксида из 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди? 51. Какой объем раствора, содержащего массовую долю соляной кислоты 10 %, плотностью 1,047 г/ см3 потребуется для нейтрализации раствора, содержащего 8,5 г гидроксида бария? 52. Какой объем раствора соды, содержащего в 1 л 21,2 г соли, надо добавить к 30 мл 0,2 н. раствора хлорида кальция для полного осаждения кальция в виде карбоната? 53. Какая масса гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) добавить избыток щелочи? 54. Какая масса гидроксида калия содержится в 1 л раствора, если на нейтрализацию 20 мл этого раствора потребовалось 13 мл 0,2 н. раствора соляной кислоты? 55. Какой объем раствора нитрата серебра, содержащего 5 г/л серебра, надо добавить к 10 мл 0,2 н. раствора хлорида натрия, чтобы полностью удалить из раствора ионы хлора? 56. Какой объем 2 н. серной кислоты потребуется для превращения 1,56 г гидроксида алюминия в сульфат алюминия? 57. Какую массу карбоната кальция можно растворить в 100 мл раствора, содержащем массовую долю соляной кислоты 20,00 %, плотностью 1,1 г/см3? 58. Какой объем раствора, содержащего массовую долю соляной кислоты 10,2 %, плотностью 1,05 г/см3 требуется для полного растворения 5 г цинка? 59. Вычислить массовую долю серной кислоты в ее растворе, если на нейтрализацию 20 мл раствора, содержащего массовую долю гидроксида калия 5,66 %, плотностью 1,053 г/см3 пошло 12,1 мл раствора серной кислоты плотностью 1,052 г/см3. 60. Какой объем 0,5 н. раствора сульфата натрия надо прилить к 100 мл раствора, содержащего массовую долю хлорида бария 16 %, плотностью 1,156 г/см3, чтобы полностью осадить сульфат-ион? Основные уравнения Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Растворимость соли в бинарной системе соль - вода соответствует ее концентрации в насыщенном растворе, т.е.
при растворении 1 моль соли образуется х моль катионов металла и у моль анионов кислотного остатка:
Уравнение закона действующих масс можно записать в следующем виде:
из которого следует уравнение расчета растворимости:
Если раствор содержит, помимо трудно растворимой соли, хорошо растворимую соль, имеющий в своем составе одноименные с составом осадка ионы, например: В присутствии одноименного аниона
Например, уравнение закона действующих масс для системы
В присутствии одноименного катиона
Например, уравнение закона действующих масс для системы
В обоих случаях приходится решать степенное уравнение второго или более высокого порядка. Растворимость осадка труднорастворимой соли слабой кислоты зависит от рН раствора из-за частичного или даже полного ее растворения в более сильной кислоте. Для соли слабой одноосновной кислоты взаимодействие с сильной кислотой протекает по уравнению:
Растворимости соли
для которого произведение растворимости
Если за растворимость принять концентрацию катионов металла, то
Для слабой одноосновной кислоты
Для слабой двухосновной кислоты типа H2R
Примеры решения задач Пример 7. Рассчитать растворимость Ag2SO4 в воде при 25°С; Решение. 1. Составить уравнение растворимости Ag2SO4:
из которого следует, что
2. Составить формулу произведения растворимости Ag2SO4:
3. Вычислить значение растворимости Ag2SO4
Пример 8. Вычислить растворимость сульфата серебра в растворе сульфата натрия концентрацией 31 г/л (плотность 1,025 г/см3); Решение. 1. Рассчитать моляльную концентрацию раствора сульфата натрия. Для этого перейти к массовой концентрации по формуле
и вычислить моляльную концентрацию:
2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
откуда
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными. Пример 9. Вычислить растворимость сульфата серебра в растворе, содержащем массовую долю нитрата серебра 3 %; Решение. 1. Рассчитать моляльную концентрацию нитрата серебра в растворе по формуле
2. Составить уравнение диссоциации нитрата серебра:
из которого следует, что концентрация иона серебра
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем нитрат серебра и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
где
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными. Пример 10. Вычислить растворимость сульфата свинца в воде; Решение. 1. Составить уравнение растворимости сульфата свинца:
из которого следует, что
2. Составить формулу произведения растворимости:
3. Рассчитать растворимость сульфата свинца в воде:
Пример 11. Вычислить растворимость сульфата свинца в растворе сульфата натрия концентрацией 0,03 г/л; Решение. 1. Рассчитать моляльную концентрацию сульфата натрия. В данном случае можно воспользоваться формулой:
т.к. величина молярной концентрации не превышает 0,01 моль/л. 2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
где
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными. Пример 12. Рассчитать растворимость сульфата свинца в растворе нитрата свинца концентрацией 0,062 моль/кг. Решение. Составить уравнение диссоциации нитрата свинца:
из которого следует, что концентрация ионов свинца
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат синца и нитрат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона
следовательно, величиной S 2 в формуле произведения растворимости нитрата свинца можно пренебречь:
7. Вычислить растворимость сульфата свинца в растворе нитрата свинца по формуле
Пример 13. Во сколько раз растворимость фторида бария в 0,01 М растворе соляной кислоты больше растворимости в чистой воде? Решение. 1. Составить уравнение растворимости фторида бария:
из которого следует, что
2. Выразить концентрацию фторидных ионов с учетом кислотности раствора:
3. Составить уравнение произведения растворимости:
4. Вычислить растворимость соли в воде
5. Вычислить растворимость соли в присутствии соляной кислоты
Пример 14. Во сколько раз растворимость оксалата кальция в растворе с рН = 3,3 больше его растворимости в воде? Решение. 1. Составить уравнение растворимости оксалата кальция:
2. Из уравнения растворимости следует, что
3. Вычислить концентрацию катионов водорода в растворе
4. Выразить концентрацию оксалат-ионов с учетом кислотности раствора
5. Составить уравнение произведения растворимости оксалата кальция
6. Вычислить растворимость оксалата кальция в воде
7. Вычислить растворимость оксалата кальция в растворе с рН = 3,3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.235.209 (0.259 с.) |
 ,
, – молярная масса химического соединения г/моль.
– молярная масса химического соединения г/моль.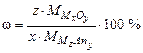 ,
, – молярная масса оксида элемента, г/моль; х – стехиометрический индекс элемента в формуле его оксида;
– молярная масса оксида элемента, г/моль; х – стехиометрический индекс элемента в формуле его оксида;  или
или  .
.









 - масса растворенного вещества;
- масса растворенного вещества;  - молярная масса растворенного вещества;
- молярная масса растворенного вещества;  - эквивалентная масса растворенного вещества;
- эквивалентная масса растворенного вещества;  - количество растворенного вещества, моль;
- количество растворенного вещества, моль;  - количество эквивалентов растворенного вещества;
- количество эквивалентов растворенного вещества;  - масса раствора;
- масса раствора;  - объем раствора;
- объем раствора;  - масса растворителя, кг; z – количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле.
- масса растворителя, кг; z – количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле. ;
; ;
; .
.




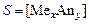 . Согласно уравнению растворимости:
. Согласно уравнению растворимости:
 и
и  .
. ,
, .
.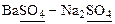 или
или  , то при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников.
, то при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников. уравнение закона действующих масс
уравнение закона действующих масс .
. :
:

 .
. :
: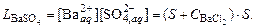
 .
. соответствует уравнение
соответствует уравнение ,
, .
. .
.
 вычисляют по уравнениям:
вычисляют по уравнениям: при
при  ;
; при
при  .
.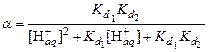 при
при  при
при  .
. ,
, .
. .
. моль/кг.
моль/кг.

 ,
,
 ;
;  .
.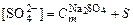
 .
. :
: ,
, ,
,

 ,
,
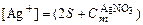 ;
; 
 .
. :
: ,
, ,
, ,
, ;
;  ;
; 
 ;
; ;
; моль/кг.
моль/кг. .
. ,
, ;
;  .
. .
. моль/кг.
моль/кг.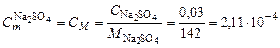 моль/кг,
моль/кг, ;
;  .
. ,
, ,
,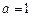 ;
;  ;
; 
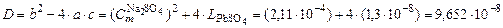 ;
; ;
;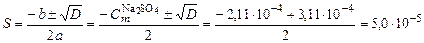 моль/кг.
моль/кг. ,
, .
.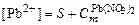 ;
;  .
.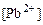 :
: ,
,
 .
. ,
,  .
. ,
, ;
;  .
.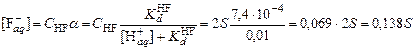
 .
. ;
; .
.
 .
.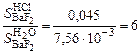 .
. ;
;  ,
,  .
. .
. ,
, 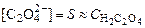 .
.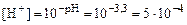 .
.
 .
. .
.


