
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические свойства предельных одноосновных карбоновых кислотСодержание книги
Поиск на нашем сайте
Первые три члена ряда С-С3 – подвижные бесцветные жидкости со жгучим запахом, смешиваются с водой. С4 и далее – маслянистые жидкости с запахом прогорклого масла, с водой не смешиваются, ратсворимость уменьшается с увеличением молекулярного веса. Неустойчивы к нагреванию. С1-С9 – жидкости; С10 и более – твердые вещества. Температуры кипения кислот высокие. У муравьиной кислоты – 1000С, дальше – еще выше. Это объясняется тем, что карбоновые кислоты образуют за счет водородных связей димеры, сохраняющиеся даже при кипении. O…….H-O СH3-C C-CH3 O-H…….O
Химические свойства карбоновых кислот Кислотные свойства а) Диссоциация в водном растворе O O R-C O-H O- По степени диссоциации – это слабые кислоты. Наиболее сильная – муравьиная кислота. У других кислот углеводородный радикал, обладающий электродонорными свойствами, отталкивает электроны к водороду (положительный индукционный эффект), и кислотность снижается. HCOOH Кд=2,14.10-4 CH3 О Степень диссоциации увеличивается при введении в радикал электроноакцепторных групп, например, групп С=О, ОН, Cl. Чем ближе эти группы расположены к СООН, тем сильнее кислота. Например, у хлоруксусной кислоты Cl О у трихлоруксусной Cl Cl Cl т.е. трихлоруксусная кислота аналогична сильным минеральным кислотам.
2) Образование солей происходит при взаимодействии с металлами, окисями, гидроокисями металлов, с некоторыми другими солями и аммиаком а) 2HCOOH + Mg формиат магния б) 2СH3COOH + CaO ацетат кальция в) С2H5COOH + NaOH пропионат натрия г) CH3COOH + NaHCO3 д) CH3COONa + AgNO3 е) CH3COOH + NH3
3) Образование производных карбоновых кислот путем замещения гидроксила (реакции ацилирования) а) Образование хлорангидридов кислот O O CH3-C + PCl5 OH Cl (или PCl3 хлорангидрид уксусной кислоты SOCl2) (хлористый ацетил) б) Образование амидов карбоновых кислот O O CH3-C + NH3 OH NH2 O O CH3-C + NH3 Cl NH2 в) Образование сложных эфиров со спиртами (см. свойства спиртов) Дегидратация кислот O O CH3-C CH3-C OH O OH CH3-C Kat O O ангидрид уксусной кислоты Реакция требует очень высокой температуры, поэтому чаще ангидриды кислот получают взаимодействием солей с хлорангидридами.
O O CH3-C CH3-C ONa Cl CH3-C CH3-C O O 5) Декарбоксилирование – отщепление СО2. У предельных одноосновных кислот идет трудно и требует высокой температуры и присутствия щелочи. В результате образуется углеводород. O CH3-C + NaOH ONa 6) Окисление. Предельные одноосновные кислоты к окислению устойчивы, за исключением муравьиной кислоты, которая проявляет свойства альдегидов. O O H-C + O H 7) Реакции в радикале. O O CH3-C + Cl2 OH OH ЛЕКЦИЯ 12
|
|||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 183; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.45.82 (0.008 с.) |

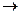 R-C + H+
R-C + H+ CH2
CH2  NH4Cl
NH4Cl H2O + CH3-C
H2O + CH3-C



