
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предельные двухосновные кислоты
Отличие в свойствах 1. Кислотные свойства более сильные. Степень диссоциации тем выше, чем ближе две группы СООН. К1 щавелевая = 3,8.10-2 К1 адипиновая = 3,9.10-5 2. Образуют кислые и средние соли, полные и неполные амиды, хлорангидриды, сложные эфиры. 3. Неустойчивы к нагреванию - разлагаются а) щавелевая и малеиновая кислоты отщепляют СО2 (декарбоксилируются) с образованием одноосновных кислот. HOOC-COOH б) янтарная и глутаровая кислоты образуют циклические ангидриды O O CH2-C CH2-C OH O OH CH2-C O O в) адипиновая кислота и следующие при нагревании отщепляют и СО2, и воду, образуя циклические кетоны. O CH2-CH2-C OH CH2-CH2 OH CH2-CH2-C CH2-CH2 O циклопентанон Реакция идет легче, если взять кальциевую соль кислоты (выделяется СаСО3). 4. Двухосновные кислоты, в отличие от одноосновных, могут окисляться.
HO-C=O OH H2O 5. Малоновая кислота отличается особой подвижностью атомов водорода в метиленовом мостике. Н – приобретает способность замещаться. Например, диэтиловый эфир малоновой кислоты при действии металлического натрия дает замещение Н на Na. + HOOC H O O C C OC2H5 OC2H5 CH2 + 2Na O O C C OC2H5 OC2H5
натриймалоновый эфир На его основе получают различные кислоты, например, COOC2H5 COOC2H5 CHNa + Br-CH2-CH3 COOC2H5 COOC2H5 -2C2H5OH O C OH
O масляная кислота C OH 6. Поликонденсация двухосновных кислот с двухатомными спиртами и диаминами O O O O nC-(CH2)4-C +n HO-CH2-CH2-OH HO OH адипиновая килота этиленгликоль этиленгликольадипинат O O O O nC-(CH2)4-C + nH2N-(CH2)6-NH2 HO OH полиамиды (найлон 66)
Непредельные кислоты Одноосновные
Двухосновные
Отличия в свойствах 1) Обладают более сильными кислотными свойствами, если двойная связь расположена через одну простую от группы СООН (т.к. углерод в состоянии sp2-гибридизации обладает более высокой электроотрицательностью.)
2) Дают реакции двойных связей а) присоединения (причем у кислот с сопряженным положением двойной связи – не по правилу Марковникова); б) окисления – с разрывом двойной связи; в) полимеризации. Полимеры непредельных кислот и их производных имеют большое практическое применение. Так, нитрил акриловой кислоты используется для получения полиакрилонитрила – волокна нитрон. -(CH2-CH-)n- C Полимерные эфиры акриловой кислоты – стеклообразные массы. Полиметилметакрилат (плексиглаз) получают, исходя из ацетона, HCN и CH3OH.
O OH CH3-C + HCN CH3 CH3 -H2O CH3 OH O O
CH3 NH2 –NH3 OCH3 C=O OCH3 ПММА 3) У геометрических изомеров непредельных карбоновых кислот ярко выражена зависимость взаимного влияния групп от их пространственного расположения. Так, цис- и транс-изомеры бутендиовой кислоты (малеиновая и фумаровая кислоты) очень сильно отличаются и по физическим, и по химическим свойствам.
Малеиновая кислота Цис-изомер – менее устойчив, в природе не встречается. Тпл=1300С. Хорошо растворима в воде. К1=1,5.10-2, К2=1,3.10-6. Хорошо растворима в воде. К1=1,5.10-2, К2=1,3.10-6. Легко отщепляет воду и образует малеиновый ангидрид. O O H-С-С H-C-C OH O OH H-C-C O O Фумаровая кислота Транс-изомер – устойчива, встречается в грибах. Тпл=2870С, плохо растворима в воде, К1=1.10-3, К2=3.10-5. Фумарового ангидрида не образуется. При сильном нагревании (3000С) образуется малеиновый ангидрид. O O H-C-C H-C-C O OH C-C-H -H2O H-C-C HO O В результате реакций присоединения малеиновая и фумаровая кислоты образуют одни и те же вещества. Например, O H-C-C OH O O H-C-COOH OH + Br2 H-C-C Br Br HOOC-C-H O Малеиновая кислота Сравнивая различия в свойствах малеиновой и фумаровой кислот, можно сформулировать основные особенности геометрической изомерии.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 406; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.240 (0.012 с.) |
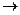 CO2 + HCOOH
CO2 + HCOOH CO2 + H2O + C=O
CO2 + H2O + C=O O CO2
O CO2 HO-C=O
HO-C=O  CO2 + HO-C
CO2 + HO-C H +
H +  C
C  + 2 CHNa
+ 2 CHNa
 N
N CH2=C-C
CH2=C-C 
 nCH2=C-C
nCH2=C-C  (-CH2-C-)n
(-CH2-C-)n O
O ,
, 


