
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронное строение нитросоединений
Нитропарафины имеют следующую октетную формулу: R:N:O: R-N+ O O Один атом кислорода образует с азотом двойную связь. Однако в реальной молекуле связи обоих атомов кислорода с азотом не отличаются друг от друга. R-N-O- O O
O-1/2 R-N+ O-1/2 Связи N-O в нитрогруппе обладают высокой полярностью, нитрогруппа имеет отрицательный индукционный эффект. H H O H H H O- В результате поляризующего влияния нитрогруппы сильно увеличивается полярность связей С-Н в
Физические свойства Так как нитросоединения содержат очень полярные связи N Нитрометан является жидкостью. Ткип=1010С. Далее температура кипения повышается. Нитросоединения обладают высокой плотностью, плотность уменьшается с увеичением радикала. Плотность нитрометана равняется 1,132. В воде растворяются мало, смешиваются со спиртом, эфиром, ядовиты. Полинитросоединения – взрывчатые вещества.
Химические свойства I. Реакции в нитрогруппе. Восстановление соединений CH3NO2 + 6H II. Реакции в радикале. Происходят за счет подвижных атомов водорода в 1) Взаимодействие со щелочами. Протекает благодаря способности нитросоединений образовывать таутомерные аци-формы. H O O O CH3-C-N H O OH ONa Нитро-форма аци-форма Нейтральные соединения, но со щелочами образуют соли с выделением воды. Ганч назвал такие соединения псевдокислотами. К псевдокислотам относятся первичные и вторичные нитросоединения. CH3 O CH3 O O CH3-CH-N O OH ONa 2) Действие азотистой кислоты а) первичные нитросоединения с HNO2 образуют нитроловые кислоты. O O O O CH3-CH-N + HO-N=O O N=O O N-OH O N-ONa O Нитроэтан нитроловая кислота таутомерная форма нитроловой кислоты Нитроловая кислота также способна образовывать таутомерные формы, которые обладают кислотными свойствами и реагируют со щелочами с образованием соли, окрашенной в красный цвет. Это качественная реакция на первичные и нитро-соединения. б) вторичные нитросоединения с HNO2 образуют псевдонитролы. O N=O O СH3-CH-N + HO-N=O CH3 O CH3 O Псевдонитрол Раствор псевдонитрола в эфире, а также расплав имеют бирюзовую окраску (качественная реакция вторичных нитросоединений).
3) Конденсация нитросоединений с альдегидами и кетонами O O OH O O CH3-C + CH3-CH2-N H O H CH3 CH3 O уксусный нитроэтан 3-нитро-2-бутанол 2-нитро-2-бутен альдегид Нитроолефины используются в производстве полименых материалов. При избытке альдегида могут образовываться многоатомные нитроспирты. O HC H O H HO-CH2 O2NOCH2 HC + H-C-NO2 H H HO-CH2 O2NOCH2 O нитрометан триоксиметил тетрит (ВВ) HC (нитрометан) H Формальдегид 4) Действие галогенов СH3-CH2-NO2 + 2Br2 нитроэтан 1,1-дибром -1-нитроэтан 3. Отличие химичесикх и физических свойств нитросоединений от свойств изомерных сложных эфиров азотистой кислоты, т.е. O R-N R-O-N=O O нитропарафинов от алкилнитратов
Физические свойства 1. Эфиры кипят при более низкой температуре 2. Нитропарафины – более полярны Химические свойства 1.Восстановление. Нитросоединения дают амины. Нитриты восстанавливаются до спирта и гидроксиламина. CH3-O-N=O + 4H Метилнитрит 2. Действие водных растворов щелочи. Нитросоединения дают соли ациформ (см. выше). Нитриты – гидролизуются. CH3-O-N=O + NaOH Отдельные представители (самостоятельно) Нитрометан, нитроэтан, нитропропан, нитробутаны. Получаются в технике нитрованием газообразных парафинов. Применение: 1. Компоненты реактивного топлива. 2. Растворители эфиров целлюлозы и виниловых спиртов. 3. Получение вулканизационных агентов. 4. Получение ВВ 5. Получение пластификаторов 6. Получение эмульгаторов и фармацевтических препаратов (из нитроолефинов).
ЛЕКЦИЯ 14 АМИНЫ Определение и классификация Это производные углеводородов, у которых один или несколько атомов водорода замещены остатками аммиака (аминогруппами). Классифицируются: 1) по количеству радикалов, связанных с аминогруппой: а) первичные амины R-NH2 б) вторичные амины R-NH-R в) третичные амины R N-R R 2) по количеству аминогрупп а) моноамины б) полиамины (диамины, триамины и т.д.)
Изомерия, номенклатура Кроме изомерии цепи и изомерии положения, амины жирного ряда имеют третий вид структурной изомерии – метамерию.
Номенклатура 1. Систематическая радикально-функциональная – перечисляются радикалы и добавляется слово “амин” (или диамин – если две аминогруппы) и т.д. (CH3-CH2-)3N H2N-CH2-CH2-NH2 триэтиламин этилендиамин 2. Систематическая заместительная – берется за основу название углеводорода, к которому добавляется приставка “ амино”. Нумерация со стороны аминогруппы. 1 2 3 4 5 6 CH2-CH-CH2-CH2-CH-CH3 NH2 CH3 NH2 1,5-диамино-2-метилгексан Получение 1. Взаимодействие галогеналкилов с аммиаком и аминами CH3-I + NH3 Йодистый -NH4I метиламмоний При избытке галогеналкила реакция идет дальше. CH3-NH2 + CH3I -NH4I +NH3 CH3 (CH3)3N: + CH3I Йодистый тетраметиламмоний (полностью замещенная аммониевая соль) 2. Действие гипохлорита на амиды кислот (реакция Гофмана) O CH3-C + NaOCl NH2 3. Восстановление нитросоединений (см. свойства нитросоединений) 4. Восстановление нитрилов кислот и изонитрилов CH3-C Физические свойства Бесцветные вещества с непприятным запахом. Метиламин, диметиламин и триметиламин – газы с запахом NH3, остальные жижкие и твердые вещества. В воде растворимы, образуют с водой водородные связи, при растворении взаимодействуют с водой. Химические свойства I. Проявляют свойства оснований. 1) Присоединяют молекулу воды с образованием гидроксидов, способных диссоциировать на ионы. CH3NH2 + HOH Гидроксид метиламмония Степень диссоциации гидроксидов зависит от влияния радикала. Основность аминов выше, чем у аммиака, т.к. положительный индукционный эффект радикалов увеличивает электронную плотность на азоте.
2) Образование солей C4H9-NH2 + H+O-SO2OH бисульфат бутиламмония O O CH3-NH2 + H+-O--C-CH3 метиламин уксуснокислый II. Атом водорода в аминогруппе обладает большой подвижностью, т.к. связь N 1) Он легко замещается на алкилы и на ацилы а) Алкилирование аминов осуществляется действием галогеналкилов, спиртов, диалкилсульфатов. C2H5 CH3NH2 + C2H5Br Метилэтиламин бромистоводородный б) ацилирование аминов проводится действием кислот, их хлорангидридов или ангидридов. Образуются N-замещенные амиды. O CH3-C O C2H5NH2 + O CH3-C O OH O N-этилацетамид CH3 O CH3 NH + CH3-C CH3 Cl O CH3 N,N-диметилацетамид 2) Взаимодействие с азотистой кислотой а) первичные амины образуют спирты CH3-NH2+HO-N=O N-нитрозометиламин метилдиазогидрат б) вторичные амины образуют только нитрозоамины CH3 CH3 NH + HO-N=O CH3 CH3 третичные амины образуют соли азотистой кислоты (CH3)3N + H+O-N=O 3) Превращение первичных аминов в изонитрилы
Cl KOH CH3NH2 + H-C-Cl + KOH Cl KOH Характерная реакция на первичные амины III. Окисление аминов Амины очень легко окисляются 1) Окисление первичных жирных аминов CH3NH2+O2+H2NCH3
нитрометан 2) Окисление вторичных жирных аминов (CH3)2NH + O + HN(CH3)2 тетраметилгидразин 3) Окисление третичных аминов (CH3)3N: + O: окись амина Применение Амины жирного ряда используются в качестве антиоксидантов, флотационных агентов, при изготовлении моющих средств. Диамины применяются для получения полимеров типа полиамидов (например, найлона – сополимера на основе гексаметилендиамина и адипиновой кислоты).
ЛЕКЦИЯ 15
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.38 (0.055 с.) |
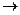 O-
O- R-N=O
R-N=O -положении к группе NO2.
-положении к группе NO2. =3,5
=3,5  4,0 Д), они обладают высокой температурой кипения.
4,0 Д), они обладают высокой температурой кипения. CH3-CH=N + H2O
CH3-CH=N + H2O (CH3)2C=N + H2O
(CH3)2C=N + H2O CH3NH2
CH3NH2 CH3-N-CH3 + NH4I
CH3-N-CH3 + NH4I N + 4H
N + 4H  Н полярна.
Н полярна. CH3-C-N
CH3-C-N CH3-NH-N=O
CH3-NH-N=O  CH3-N=N-CH3
CH3-N=N-CH3  2CH3N=O
2CH3N=O 


