Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация органических реакций по механизму
Механизмы реакций органических соединений зависят от того, каким образом разрушаются химические связи. Ковалентная связь может разрушаться двумя основными способами: 1. Разрыв связи, происходящий с разъединением электронной пары, называется гомолитическим расщепление м.
Промежуточно при этом образуются активные незаряженные частицы, имеющие неспаренный электрон, свободные радикалы. Так как эти частицы не заряжены – реакции, протекающие с их участием, называют гомеополярными или свободно-радикальными. Образование новой химической связи в этих реакциях идет за счет обобщения неспаренного электрона углерода с неспаренным электроном реагента, например:
Гомеополярные реакции имеют преимущественное значение для соединений с неполярными или малополярными связями. 2. Разрыв связи, происходящий без разъединения электронной пары, называется гетеролитическим расщеплением. Гетеролитическое расщепление связи приводит к образованию частиц с противоположными зарядами, поэтому такие реакции называются гетерополярными. Существуют два вида гетерополярных реакций: а) электронная пара разрушающейся связи остается у атома углерода. Например:
Н/ Н/
Н / Н / б) электронная пара разрушающейся связи отрывается от углерода. Например: H-C:Cl ® H-C + +:Cl- H/ H/ КАРБКАТИОН Н \ Н\
Н / Н/ Реагент является частицей нуклеофильной, механизм реакции также называется нуклеофильным.
Все гетерополярные реакции легче протекают для соединений с полярными или легко поляризующимися связями и под действием полярных реагентов. Кроме классификации по механизму, реакции различаются по типам (направлению реакций), например, замещения (S – substitution), присоединения (A – adduction), отщепления (E – elimination), и по молекулярности, по порядку медленной стадии реакции. определяющей скорость всего процесса (моно-, бимолекулярные и др.). Например:
r=K[C2H5OH][HBr]
Лекция № 2 I. АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ (ЖИРНЫЕ, АЦИКЛИЧЕСКИЕ) А. Предельные (насыщенные) углеводороды (парафины, алканы, метановые углеводороды). Определение. Это углеводороды с открытой цепью углеродных атомов, связанных не только простыми связями, все остальные валентности углерода до предела насыщены водородом. Их можно расположить в порядке увеличения числа атомов углерода
При этом образуется гомологический ряд. Общая формула этого ряда СnН2n+2, где n – число атомов углерода. Гомологический ряд – это ряд соединений одного класса, отвечающих общей молекулярной формуле, где каждый последующий член ряда отличается от предыдущего на метильную группу СН2. Члены одного ряда обладают общими химическими свойствами и закономерно изменяющимися физическими свойствами. С 4 члена ряда наблюдается появление изомеров, отличающихся строением углеродной цепочки.
Это называется изомерией цепи. Число изомеров быстро увеличивается с увеличением числа n.
Для составления названий этого множества соединений используют специальные системы названий (номенклатуру). Необходимо знать следующие системы названий: ü по греческим числительным, с окончанием –ан (см.выше); ü рациональную номенклатуру;
ü международную номенклатуру (1892 г. – Женевская; 1930 г. – Льежская; 1957-1965 гг. – UPAC, Москва). В рациональной номенклатуре за основу принимается простейший член ряда – метан. Заместители в названии перечисляются перед названием основы в порядке возрастания сложности. При наличии одинаковых заместителей перед названием заместителя ставится множащая приставка (ди-, три-, тетра-). Например: диметилпропилметан
остаток метана
В систематической номенклатуре за основу берется самая длинная углеродная цепь. Эта цепь нумеруется с того конца, к которому ближе располагается разветвление. Радикалы, не вошедшие в основную цепь, перечисляются перед названием основы в порядке возрастания сложности, положение их указывается цифрами. Количество цифр должно соответствовать количеству заместителей. Название основы строится исходя из соответствующего греческого числительного с окончанием "ан". Например:
2, 4-диметил-3-изопропилгексан
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.200.143 (0.006 с.) |

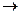


 Н \ + - Н \
Н \ + - Н \
 Н-С-: +Вr: Вr Н-С-Вr + Вr -
Н-С-: +Вr: Вr Н-С-Вr + Вr - Н-С+ + К+ОН- Н-С-ОН + К+
Н-С+ + К+ОН- Н-С-ОН + К+ С2Н5ОН + НBr H2O + C2H5Br протекает по механизму SN2 - бимолекулярная реакция нуклеофильного замещения.
С2Н5ОН + НBr H2O + C2H5Br протекает по механизму SN2 - бимолекулярная реакция нуклеофильного замещения.