
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтальпиметрические биосенсорыСодержание книги
Поиск на нашем сайте В аналитических устройствах такого рода производится регистрация теплового эффекта биохимического процесса. Энтальпиметрические биосенсоры могут быть построены на основе ферментов, поскольку они катализируют многие экзотермические процессы, рапример, окисление глюкозы кислородом (глюкозооксидаза и каталаза): глюкоза + ½ О2 ® глюконовая к-та + Н+ + 49,5 ккал/моль. Теплота этого процесса состоит из энтальпии реакции окисления глюкозы, диссоциации глюконовой кислоты и разложения перекиси водорода под действием каталазы. Энтальпиметрические биосенсоры зачастую позволяют определять содержание субстратов в малых объемах проб и отличаются от электрохимических биосенсоров более простой регистрирующей аппаратурой. В табл. 7 приведены характеристики некоторых энтальпиметрических биосенсоров.
Таблица 7 Характеристики энтальпиметрических биосенсоров на основе Иммобилизованных ферментов
В подавляющем большинстве энтальпиметрические биосенсоры представляют собой устройства в виде мини-реакторов. В основе определения ингибиторов термометрическим методом лежит способность некоторых веществ инактивировать ферменты. Аналитическим узлом такого биосенсора – анализатора ионов тяжелых металлов – является мини-колонка с иммобилизованным ферментом (например, уреазой). Ингибированные ферменты определяются следующим образом: проба 0,5 М мочевины прокачивается в течение 30 с через реактор, затем вводится проба ингибитора, а через 30 с – 0,5 М мочевины. Степень ингибирования равна относительной теплоте, выделяемой после введения ионов. Уреаза регенерируется путем пропускания через реактор раствора йодида натрия и ЭДТА в течение 3 мин. Ионы йода следующим образом восстанавливают ферментативную активность:
E–Hg + 2I- ® E + HgI2 HgI2 + 2I- ® HgI42-, где E–Hg – инактивированный ионами ртути фермент E. Стабильность комплекса HgI42 настолько высока,что ферментативная активность регенерируется полностью после многократного отравления биокатализатора. Аналитическая система позволяет определять ионы тяжелых металлов в концентрациях 40—300мкМ. Анализатор имеет ряд преимуществ перед атомно-адсорбционной спектроскопией, главными из которых являются простота измерения и возможность непрерывного контроля концентрации тяжелых металлов в экологических системах. Энтальпиметрические биосенсоры могут быть созданы на основе иммобилизованных антител (антигенов), меченных ферментами, катализирующими экзотермические реакции. Принципиальная схема таких устройств почти не отличается от энтальпиметрических систем, содержащих ферменты.
Термометрические микробные Биосенсоры Практически все реакции, катализируемые ферментами микроорганизмов, протекают с изменением энтальпии. Даже небольшие изменения в метаболизме клетки связаны с изменением тепловыделения. Тепловые эффекты в процессах жизнедеятельности микроорганизмов являются основой действия, например, микробного термистора Маттиассона, в котором стеклянная изолированная колонка (0,6х4 см) заполнена иммобилизованными в акриламидном геле клетками пекарских дрожжей. В иммобилизованном состоянии более 6–8 % клеток жизнедеятельны. При пропускании через колонку раствора глюкозы генерируется тепло. Препараты иммобилизованных клеток стабильны более 7 дней при непрерывной эксплуатации в колонке. По истечении этого срока происходит ее закупоривание. Микробный термистор дает ответ не только на субстраты, но и на другие соединения, важные для жизнедеятельности микроорганизмов. Так, добавление в раствор глюкозы раз-общителя окислительного фосфорилирования 2,4-динитрофенола при-водит к увеличению тепловыделения на 20 %, 2 мМ арсената, ингибирующего глицеральдегид-3-фосфатдегидрогеназу, замедляет выделение теплоты. Для определения противогрибковых антибиотиков может быть применен проточный микрокалориметр. Действие системы основано на способности антибиотиков, в частности нистатина, связываться с компонентами мембран клеток микроорганизмов, в результате чего образуются поры. Ионы аммония, калия, белки и другие компоненты выходят из клетки, что приводит к гибели микроорганизмов. Приведенные результаты и возможность широкого подбора штаммов микроорганизмов указывают на большую перспективу термохимических микробных сенсоров как аналитических систем.
Оптические биосенсоры
Принципиально работа биосенсорных устройств на основе оптических датчиков тест-реакции не отличается от рассмотренных выше. Однако содержание продуктов реакции или исходного реагента оценивается по его оптическим свойствам или по изменению оптических свойств дополнительных зондов, взаимодействующих с продуктами реакции или исходными реагентами. Подробно работа таких датчиков была рассмотрена в главе 3. В этой же главе указывалось, что оптические методы считаются более информативными, чем электрохимические. Поэтому для демонстрации расширения возможностей конструирования биосенсоров на основе оптических датчиков тест-реакции рассмотрим принцип действия и конструкцию биосенсора на основе иммобилизованного рецептора – конканавалина А, предназначенного для определения содержания глюкозы. Этот биосенсор представляет собой конструкцию, состоящую из волоконнооптического светопровода, соединяющего с источником и детектором излучения замкнутую ячейку, отделенную от анализируемой среды полупроницаемой мембраной (рис. 20). Кроме рецептора, в измерительной ячейке находится декстран, меченный изотиоцианнатом флюоресцеина. Конканавалин А иммобилизован на внутренней поверхности полупроницаемой мембраны. Молекулы декстрана не способны диффундировать через полупроницаемую мембрану, в то время как глюкоза относительно легко диффундирует через нее. В отсутствие глюкозы меченый декстран (А*) связывается с рецептором Â: А* + Â «[А* Â].
Это приводит к тому, что большая часть меченого декстрана оказывается иммобилизованной на поверхности мембраны, что в свою очередь резко снижает флуоресценцию внутри ячейки (регистрируется излучение, составляющее менее 20 % от максимальной величины). Когда присутствует глюкоза, отмечается конкуренция между молекулами декстрана и углевода за места связывания на рецепторе. При этом часть молекул декстрана оказывается растворенной в объеме среды внутри ячейки. Причем чем больше концентрация глюкозы в анализируемой пробе, тем выше содержание растворенного декстрана внутри ячейки. Это, в свою очередь, приводит к возрастанию флуоресценции.
оптическое волокно глюкоза декстран конконавалин А
Рис. 20. Схема биосенсора для определения содержания глюкозы Описанный биосенсор весьма компактен (длина ячейки не превышает 2 мм, а диаметр 300 мкм), наличие волоконнооптического светопровода позволяет располагать измерительную аппаратуру на значительном расстоянии от датчика. С помощью этого биосенсора можно определить содержание глюкозы в крови непосредственно в сосудах. ОСОБЕННОСТИ ПРИМЕНЕНИЯ ОКСИДОРЕДУКТАЗ В БИОСЕНСОРНЫХ УСТРОЙСТВАХ
Механизм действия многих оксидоредуктаз обусловлен наличием низкомолекулярных соединений небелковой природы (коферментов), каковыми являются никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ) в окисленной и восстановленной формах. В ходе реакции коферменты расходуются в количествах, эквивалентых содержанию субстрата:
Указанная реакция обратима, положение равновесия определяет соотношение потенциалов продукта и кофермента. Безреагентные аналитические системы могут быть созданы лишь при регенерации коферментов. Образующиеся в каталитическом процессе окисленные или восстановленные коферменты могут регенерироваться несколькими способами, в том числе ферментативным, химическим и электрохимическим.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 456; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |






 возбуждение
возбуждение






 флуоресценция
флуоресценция
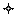
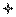
 мембрана
мембрана
 SH2 + НАД(Ф) S + НАД(Ф)H + H+
SH2 + НАД(Ф) S + НАД(Ф)H + H+


