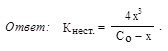Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К лабораторному ЗАНЯТИЮ № 16
Литература для подготовки: [1] – С. 167–169; [5] – С. 11, 13; [8] – С. 8–14. Базисные вопросы: 1. Диссоциация комплексных соединений в растворах. Диссоциация внутренней сферы комплекса как равновесный процесс. Константа нестойкости комплекса (Кнест) как количественная характеристика равновесия «комплекс D комплексообразователь + лиганды». Выражение Кнест через равновесные концентрации иона-комплексообразователя и лиганда в растворе для комплексов различных типов (с различными координационными числами комплексообразователя). 2. Взаимосвязь равновесных концентраций (моль/л) иона-комплексообразователя (х) и лиганда в растворе, начальной концентрации комплекса (С0, моль/л) с константой нестойкости. Формулы, связывающие параметры Кнест, х, С0 для комплексов различных типов. Р а с ч е т х при известных Кнест и С0. 3. Сравнение комплексов по прочности связывания комплексообразователь – лиганд: критерии и р а с ч е т ы. 4. Смещение равновесия «комплекс D комплексообразователь + лиганды». Влияние одноименных ионов (молекул) на устойчивость комплекса. Разрушение комплексов посредством окислительно-восстановительных, кислотно-основных, гетерогенных реакций и реакций комплексообразования. ПРИЛОЖЕНИЕ № 16 Часть А 1. Запишите все процессы, протекающие в водных растворах следующих комплексных соединений: а) нитрата диамминсеребра(I); б) сульфата тетраамминцинка(II); в) гексацианоферрата(II) калия. 2. Напишите выражения констант нестойкости указанных в предыдущем задании комплексов через равновесные концентрации иона-комплексообразователя и лиганда в растворе. 3. Для комплексного иона [Ag(NH3)2]+ выведите формулу, связывающую его константу нестойкости (Кнест.) с равновесными концентрациями (моль/л) ионов Ag+ (х) и молекул NH3 в растворе и начальной концентрацией комплекса (С0, моль/л).
4. Рассчитайте равновесную концентрацию ионов Ag+ (моль/л) в 0,1 М водном растворе [Ag(NH3)2]NO3 (в приближении, что равновесная концентрация комплекса равна начальной).
5. В каком из приведенных ниже комплексов (при одной и той же температуре) аммиак связан прочнее? а) [Cu(NH3)4]SO4; б) [Zn(NH3)4]SO4.
6. Рассмотрите растворение комплекса [Cu(NH3)4]SO4 в
а) воде; б) водном растворе аммиака; в) водном растворе CuSO4. Запишите все процессы. Одинаковая ли будет устойчивость комплекса (при одной и той же температуре) в этих трех случаях? Часть Б 1. Рассчитайте концентрацию цианид-ионов в 0,1 М водном растворе дицианоаргентата(I) калия.
2. Требуется максимально снизить концентрацию цианид-ионов в водном растворе. В наличии имеются: а) хлорид калия; б) хлорид железа(II); в) хлорид железа(III); г) нитрат серебра(I). Какому электролиту отдадите предпочтение и почему?
3. Рассчитайте, как изменится концентрация ионов Ag+ в растворе, если растворять комплекс [Ag(NH3)2]NO3 до концентрации 0,1 М не в воде, а в 1 М водном растворе аммиака. Будет ли разрушаться комплекс в последнем случае, если в раствор добавить хлорид натрия в соизмеримых с комплексом молярных количествах?
4. Предложите возможные варианты разрушения комплексного иона [Ag(NH3)2]+ с использованием: а) окислительно-восстановительных процессов; б) кислотно-основных взаимодействий; в) реакций комплексообразования; г) гетерогенных реакций. 5. Проанализируйте, что будет происходить при добавлении к 0,1 М водному раствору дицианоаргентата(I) калия а) сульфида калия в молярном соотношении 2:1; б) иодида калия в молярном соотношении 1:1.
6. Можно ли приготовить раствор комплексной соли [Ag(NH3)2]Cl в воде (в частности, с концентрацией 0,1 моль/л)?
ПЛАН ПОДГОТОВКИ
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.006 с.) |