
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика отбеливаюхих реагентов и способы полученияСодержание книги
Поиск на нашем сайте
Свойства основных отбеливающих реагентов и способы их получения Хлор – газ зеленовато-желтого цвета, в 2.5 раза тяжелее воздуха. При комнатной температуре (15…200С0) и давлении 0.6 МПа легко превращается в жидкость. При атмосферном давлении жидкий хлор кипит и испаряется при температуре – 33.60С. Хлор получают путем электролиза водных растворов NaCl или KCl. Гидроксиды натрия или калия, водород и молекулярный хлор являются продуктами электролиза. При растворении в воде хлор гидролизуется с образованием соляной и хлорноватистой кислот.
При повышении температуры и увеличении степени разбавления в растворе преобладает хлорноватистая кислота, при подкислении раствора равновесие реакции смещается влево, т.е. увеличивается содержание молекулярного хлора. Хлор токсичен и требует при работе с ним соблюдения специальных правил безопасности. В присутствии влаги хлор вызывает сильную коррозию металлов, поэтому хлоропроводы, отбельные башни, ванны фильтров изготавливаются из титана. Гипохлорит натрия – соль хлорноватистой кислоты. Получают при насыщении растворов соды или гидроксида натрия хлором. Водные растворы гипохлоритов представляют собой равновесную систему, в которой в результате гидролиза присутствуют гипохлорит и хлорноватистая кислота. Na+ + ClO- + H2O → Na+ + OH- + HOCl Состав раствора гипохлорита в значительной степени зависит от рН раствора. При рН менее 2 в растворе преимущественно содержится молекулярный хлор, в интервале рН 2-3 появляется также хлорноватистая кислота, при рН 4-6 присутствует только хлорноватистая кислота. Повышение рН более 7 приводит к увеличению концентрации ионов гипохлорита, и при рН более 9 в растворе будут находиться только ионы гипохлорита. Растворы гипохлорита склоны к саморазложению, чему способствует повышение температуры, степени разбавления, действие солнечного света. В результате разложения гипохлорита образуются хлораты (ClO3-) и хлориты (ClO2-). Диоксид хлора – удушливый, токсичный, дурнопахнущий газ, имещий оранжево-желтый цвет. При охлаждении до температуры -11°С и атмосферном давлении превращается в жидкость красного цвета. Газообразный диоксид хлора разлагается на хлор и кислород со взрывом, поэтому применяется в виде водных растворов концентрацией не более 10 г/л.. Водные растворы ClO2 наиболее устойчивы в кислой среде. С повышением величины рН диоксид хлора гидролизуется с образованием хлорноватой, хлористой и соляной кислот:
Получают диоксид хлора путем восстановления хлоратов. Наиболее часто используемыми восстанавливающими реагентами являются диоксид серы (метод Холста и Мэтисона), метанол (способ Сольвея, R8/SVP-LITE), соляная кислота (способ Кестинга, R3H), хлорид натрия (R3/SVP), пероксид (SVP-HP(-А), которые взаимодействуют с хлоратом по следующим уравнениям реакций:
Диоксид хлора является самым эффективным отбеливающим реагентом. Кислород – основным промышленным способом получения является разделение предварительно сжиженного воздуха путем низкотемпературной ректификации. Кислород обладает низкой растворимостью в воде. Пероксид водорода Н2О2. - это прозрачная бесцветная жидкость. Он используется только в водных растворах и смешивается с водой в любых пропорциях.. В чистом виде и при низкой величине рН пероксид водорода является относительно стабильным соединением. Реакция разложения пероксида водорода происходит в присутствии металлов переменной валентности. Ускорению этой реакции способствуют нагрев, высокое значение рН и солнечный свет. Озон – является сильным окислителем и очень токсичным газом. Озон почти всегда получают по месту использования из-за его нестабильности. Озон, используемый для отбелки, получают из кислорода пропусканием коронного разряда. Генератор озона представляет собой два механических электрода, разделенных диэлектриком. Поскольку озон является весьма токсичным газом, отходящие из отбельной установки газы должны пройти через систему, разрушающую озон. Разрушение озона происходит либо на специальных катализаторах, либо при нагревании до температуры выше 300 °С. Кроме того, в отходящих газах содержатся продукты разрушения лигнина и углеводов, для которых также необходимо каталитическое разрушение до СО2. Около 90 % энергии при производстве озона расходуется на нагрев газовой смеси.
|
||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 386; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.195.30 (0.009 с.) |

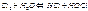





 +Q Количество кислорода, выделяющегося при разложении зависит от концентрации пероксида водорода. Основным способом получения Н2О2 является антрахинонный способ, сырьем для которого является водород (Н2) и кислород (О2)
+Q Количество кислорода, выделяющегося при разложении зависит от концентрации пероксида водорода. Основным способом получения Н2О2 является антрахинонный способ, сырьем для которого является водород (Н2) и кислород (О2)


