
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния реального газа
Все полученные выше уравнения состояния справедливы только для идеальных газов. Состояния реальных газов могут описываться этими уравнениями только приближенно, поскольку здесь не учитываются силы взаимодействия между молекулами и объемы самих молекул. За прошедшее столетие различными авторами было предложено значительное число уравнений состояния реального газа. Наибольшее применение в настоящее время имеет уравнение, полученное в 1873 г. голландским физиком Ван-дер-Ваальсом: (p + где Физический смысл поправки b состоит в следующем. У реального газа молекулы занимают определенный объем, и между ними существуют силы взаимодействия. При нормальных состояниях эти силы проявляются как силы притяжения, возрастающие с уменьшением расстояния между молекулам. Но такая закономерность замечается до определенного сближения молекул. При дальнейшем уменьшении расстояния между ними возникают силы отталкивания, величина которых тем больше, чем ближе молекулы друг к другу. Силы отталкивания при некотором расстоянии между молекулами становятся такими огромными, что никакие давления далее не способны уменьшить объем газа. Величина b и есть наименьший объем, до которого представляется возможным сжать газ. Поправка на давление вытекает из следующих соображений. У реальных газов между молекулами существуют силы притяжения. По этой причине давление реального газа имеет меньшее значение, чем давление идеального газа при одинаковых p и T,на величину ∆р: P= Величина ∆р пропорциональна квадрату числа молекул в единице объема. Поскольку молекулы реального газа обладают массой, то ∆р пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема. Коэффициентом пропорциональности является величина a, тогда ∆p = a / v2. Величины a и b называются и н д и в и д у а л ьн ы м и п о с т о я н н ы м и и зависят только от природы газа. Они могут быть определены как теоретически, так и опытным путем. Их численное значение, например, для азота следующее: a = 0,135 (Н· м4)/кг2 и b = 0,386 10-4 м3/кг.
2.1.2. Газовые смеси В большинстве случаев в качестве рабочих тел термодинамических систем используются не однородные газы, а их смеси, например, воздух, природный газ, продукты сгорания топлива и т.д.
Газовыми смесями называют механические смеси отдельных газов при условии отсутствия в них химических реакций. Длительное изучение газовых смесей позволило установить их некоторые особенности: – каждый газ, входящий в смесь, занимает весь ее объем и имеет ее температуру; – каждый газ, находящийся в смеси, подчиняется своему уравнению состояния; – каждый газ, занимающий объем смеси и имеющий температуру смеси, производит соответствующее индивидуальное давление на оболочку сосуда. Это давление называется п а р ц и а л ь н ы м. Чтобы определить параметры газовой смеси, необходимо знать количество каждого газа, составляющего смесь, т.е. знать состав смеси. Состав смеси может быть задан парциальным давлениями, массовыми или объемными долями. Задание смеси парциальными давлениями Парциальное давление обозначается через p i. Если в смеси находится n газов, то сумма их парциальных давлений равна давлению смеси: р см = p 1 + p 2 + … + p n = Это равенство носит название закона Дальтона. Задание смеси массовыми долями Массовой долей называется отношение массы данного газа к массе газовой смеси. Массовая доля обозначается через gi и определяется по выражению: g i= mi /mсм. (2.14) Сумма массовых долей равна единице:
Задание смеси объемными долями. Объемной долей называется отношение приведенного объема данного газа к объему всей смеси. Под приведенным объемом понимают такой объем, который занимал бы индивидуальный газ, имея давление и температуру смеси. Объемную долю обозначается через ri и определяется по выражению: r i = V i / V см, (2.15) где V i – приведенный объем. Сумма объемных долей равна единице:
Получим соотношения между парциальными давлениями, массовыми и объемными долями. Запишем уравнение состояния для i -го газа, находящегося в смеси, pi Vсм = m i R iT см. Если этот газ займет свой приведенный объем, то его уравнение состояния будет иметь вид: pсм Vi = m I R I Tсм. Разделив эти уравнения друг на друга, будем иметь: р i = ri pсм. (2.16) Выразим массовую долю i-го газа через его объемную долю и парциальное давление, используя выражения (2.7), (2.14) и (2.16):
. Отсюда ri = g i и pi = gi Здесь μсм – молярная масса смеси. Под Выражения для вычисления молярной массы смеси газов можно получить из (2.17) и (2.18).. Суммируя по i массовые доли в уравнении (2.17), будем иметь:
Отсюда
Аналогично из уравнения (2.18) получимчим:
Отсюда Газовая постоянная смеси определяется по известной величине кажущейся молярной массы из соотношения: Rсм =
|
||||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 214; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.247.196 (0.01 с.) |
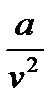 )(v - b) = RT, (2.12)
)(v - b) = RT, (2.12) и b – постоянные для конкретного газа величины.
и b – постоянные для конкретного газа величины. – ∆p.
– ∆p. . (2.13)
. (2.13)
 .
.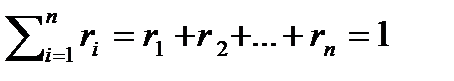 .
. . (2.17)
. (2.17) (2.18)
(2.18) . (2.19)
. (2.19)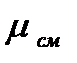 понимают молярную массу условного газа, у которого в массе m, равной массе смеси, содержится число молей M, равное числу молей в газовой смеси.
понимают молярную массу условного газа, у которого в массе m, равной массе смеси, содержится число молей M, равное числу молей в газовой смеси. ,
, , (2.20)
, (2.20) . (2.21)
. (2.21) .
. .
. 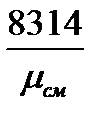 . (2.23)
. (2.23)


