Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы координационных соединений и характерные особенности координационных соединений. Классификация лигандовСодержание книги
Поиск на нашем сайте Одной из частей данной работы, будет получение комплексов или координационных соединений гидразидов ГК с тяжелыми металлами. Для того что бы понять как происходить комплексообразование, нужно рассмотреть основные понятия, классификации и закономерности процесса комплексообразования. 1. Важнейшей особенностью координационных соединений является то, что число ближайших «соседей» у центрального атома превышает его собственную валентность (степень окисления). Вследствие этого образуются дополнительные координационные связи, зачастую имеющие донорно-акцепторный характер. Например, для комплексов Вернера, комплексное соединение представляет собой ядро – центральный атом металла комплексообразователя – и координированные лиганды, которые в случае вернеровских комплексов могут представлять собой заряженные ионы (кислотные остатки неорганических и простейших органических кислот) или нейтральные молекулы (вода, аммиак, амины и др.). Число ближайших соседей определяется координационным числом металла-комплексообразователя. В зависимости от координационного числа и пространственного расположения лигандов (точнее, их донорных атомов – для аммиака это атомы азота) различают различные пространственные структуры: ▪ квадрат (координационное число 4) ▪ тетраэдр (координационное число 4) ▪ бипирамида (координационное число 5, 6, 7 и т.д.) ▪ тетрагональная пирамида (координационное число 5) ▪ октаэдр (координационное число 6) Совокупность иона металла-комплексообразователя и лигандов образую так называемую внутреннюю координационную сферу. Именно ее состав и строение определяют физико-химические свойства и реакционную способность комплекса. Поэтому именно последней уделяется особое внимание при изучении и обсуждении свойств комплексов. 2. Вторая особенность заключается в изменчивости свойств комплекса и самой координационной связи в зависимости от того, какие лиганды и типы связывания реализованы во внутренней координационной сфере. Данное свойство получило название лабильности комплексов (и координационной связи). В органической химии для конкретных связей (например, С=О, С–Н, С=N, С–С, С–О, С=С и др.) существует определенный набор характеристик: длина связи, ее дипольный момент, поляризуемость, валентный угол, образуемый данной связью по отношению к прочим связям в молекуле, рефракция. Для координационной связи между двух атомов такого набора не существует, поскольку каждая величина зависит не только от того, какие именно атомы ее образуют, но и от того какие атомы и связи соседствуют с указанной парой атомов (частиц).[63] 3. Но пожалуй, одной из важных аспектов, которые стоит рассматривать в контексте данной работы подробно, это разнообразие лигандов, образующих комплексы. В источнике [63] рассмотренны основные типы лигандов, дающие координационные соединения. Опираясь на эти данные, рассмотрим лишь некоторые из основных. Амины (первичные, вторичные, третичные)
Нитрилы
Имины и оксимы
Производные гидразина
Следует заметить, что R-, R1-, R2- радикалы, не являются пассивными заместителями, а играют уникальную, и чаще всего определяющую, роль при организации структуры комплекса и определении тех или иных свойств. Так простейшие производные гидразина (показанные выше), содержащие в качестве заместителей тривиальные ароматические или алифатические радикалы, дают с переходными металлами довольно простые координационные соединения, называемые молекулярными комплексами или аддуктами (от англ. to add – добавлять). Введение же в их молекулы карбонильной группы (С=О) дает так называемые гидразиды органических кислот (ацил- и ароилгидразины) и гидразоны (ацил- и ароилгидразоны карбонильных соединений), получаемые по реакции конденсации соответствующего карбонильного соединения – альдегида или кетона – с соответствующим гидразидом кислоты. При координации данных соединений атомом металла лиганд может координироваться в двух таутомерных формах, одна из которых кето-иминная, а вторая ен-иминная:[63]
Именно за счет таких трансформаций лигандов происходит образование комплексов особого типа, их называют внутрикомплексными соединения или металлохелатами:
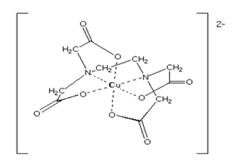
Атом металла в такие соединения, входит как, включенный в молекулу комплекса с помощью двух типов связей –химической и связи, образованной с помощью донорно-акцепторного механизма. Радикалы, находящиеся в гидразоновой части молекулы могут влиять на пространственную изомерию. Лиганды могут занимать в координационной сфере одно или несколько мест, т.е. соединяться с центральным атомом посредством одного или нескольких атомов. По этому признаку различают монодентатные, дидентатные, тридентатные, полидентатные лиганды (от лат. dentalus — имеющий зубы). Примерами монодентантных лигандов являются ионы СГ, F", ОН", молекулы NH3, Н20, СО и др. К бидентантным относится, например, молекула этилендиамина H2N—СН2—СН2—NH2 (сокращенное обозначение en). Комплексы с полидентантными лигандами называются хелатными (или клешневидными, от греч. chelate — клешня). Например, нехелатный и хелатный комплексы меди (II), рис 7 [64].
Рис. 7 Хелатный комплекс меди [64] Образование комплексных соединений гуминовых веществ с металлами. Разнообразие функционального состава гуминовых веществ определяет их способность к связыванию большого числа видов ионов металлов (Cu+2, Cd+2, Pb+2, Zn+2, Hg+2, Pb+2 и др.) [65-68]. В настоящее время, когда экологический риск и опасность возросли, наибольший интерес, с точки зрения экологии, вызывает взаимодействие ГВ с радионуклидами и тяжелыми металлами (ТМ), которые являются одними из опаснейших классов загрязняющих веществ. Образование комплексов с гуминовыми веществами переводит ТМ и радионуклиды в низкотоксичную малоподвижную форму. Всё количество взаимодействий ГВ с металлами по характеру связи «ГВ-металл» в образующихся соединениях можно разделить на три основных типа [7, 10, 65,68]: 1) Солевого типа с ионной связью между анионом ГВ и катионом металла (гуматы и фульваты щелочных щелочноземельных металлов). 2) Соединения с преимущественно ковалентным характером связи ГВ-металл. По данному типу ГВ связываются с поливалентными катионами (Al, Fe, Si), входящими в структуру глинистых частиц. 3) Комплексные соединения с координационной связью ГВ-металл. Данный тип связывания с ГВ характерен для переходных металлов. В подавляющем большинстве соединений связь носит смешанный характер с преобладанием того или иного типа в зависимости от природы катиона [71, 73]. Единого взгляда на природу комплексообразующих центров ГВ до сих пор не существует [10]. Это связано со сложностью качественной и количественной интерпретации данных тех методов, которые применимы для исследований ГВ и дают информацию о типе образующихся комплексов. Однако, основываясь на исследованиях функционального состава ГВ, а также ИК- и ЭПР-спектров комплексов тяжелых металлов с ГВ, полагают, что за взаимодействие гуминовых веществ с ТМ и радионуклидами ответственны следующие структурные фрагменты [10]:
Считается также возможным участие в данном процессе групп, содержащих гетероциклический или аминный азот [7, 8, 10]. Однако, ввиду низкого процентного содержания азота, этот тип связывания не может играть существенной роли. Согласно данным работ [10, 12, 70], в металло-гуматном взаимодействии определяющую роль играют карбоксильные группы, входящие в состав двух основных типов связывающих центров: салицилатных и фталатных. В то же время в работах [71,72] указывается на существенный вклад группировок типа пирокатехина. Рассмотренные выше связывающие центры характерны для ГВ терригенного происхождения с высоким содержанием ароматических структур. Для ГВ аквагенного происхождения, отличающихся преобладанием в углеродном скелете алифатических фрагментов, взаимодействие ГВ с металлами определяется, в основном, карбоксилат-ионами, эфирными группами, и комбинациями различных групп. Следовательно, доля хелатных взаимодействий для аквагенных ГВ существенно меньше, что, возможно, и стало причиной более низкой устойчивости их комплексов [73]. Гуминовые вещества оказывают большое влияние на токсичность ТМ в почвенных системах, переводя их в низкотоксичную закомплексованную форму. Согласно данным [74, 75] около 90% меди и 70% кадмия дезактивируются в присутствии природных концентраций ГВ. Следует отметить, что особенно сильное детоксицирующее действие проявляют низкомолекулярные ФК, характеризующиеся более высоким содержанием функциональных групп. Детоксицирующее действие ГВ по отношению к ТМ обусловлено и сорбцией металлов на твердых гуминовых веществах [76]. В работах [77,78] было показано, что сорбционная способность ГВ гораздо выше таковой для минеральных компонентов почвы. Поэтому при одинаковом валовом содержании ТМ из минеральных почв растения поглощают больше тяжелых металлов, чем из богатых органическим веществом [7, 9]. В работе [12] приводится ряд сорбируемости катионов металлов гуминовыми веществами: Fe+3 > Al+3 > Cu+2 >> Zn+2 > Co+2 >> Mn+2. Отмечено, что полученный ряд совпадает с рядом по произведениям растворимости соответствующих гидроксидов: чем ниже произведение растворимости, тем большее количество металла сорбируется на ГВ. Следовательно, ГВ участвуют в регулировании соотношения подвижных (доступных растениям) и неподвижных (недоступных растениям) форм тяжелых металлов, воздействуя тем самым на процессы биоаккумуляции и токсические эффекты радионуклидов и ТМ [78, 79]. Нужно так же отметить что комплексообразующие свойства в сочетании с окислительно-восстановительными свойствами ГВ очень важны с геохимической точки зрения. Как было показано, гуминовые вещества определяют формы существования металлов с переменной валентностью (Cr, Np, Pu и др.) в окружающей среде, влияют на их миграцию и биодоступность. 2.1.8. Положительные экологические последствия комплексообразования ионов тяжелых металлов с гуминовыми веществами Важно отметить, что, взаимодействие гумусовых кислот с тяжелыми металлами (ТМ) является одним из основных факторов, влияющих на поведение этого класса токсикантов как в водной, так и в почвенной средах. Гуминовые и фульвокислоты (ГФК) определяют миграционную способность и биодоступность ТМ, в значительной степени, а так же способствуют повышению буферности экосистем по отношению к этим загрязнителям. Влияние ГФК на подвижность металлов в почвах и водах определяют два конкурирующих процесса: сорбционное концентрирование за счет образования нерастворимых комплексов с ГК и увеличение миграционной способности при комплексообразовании с ФК [81]. Было установлено, что миграционная способность фульватов Mn в почве в 1,5-3 раза выше чем ионных форм, а вымывающее действие ФК в 3-5 раз эффективнее по сравнению с дистиллированной водой. В то же время в работах было показано, что ГК активно фиксируют ТМ наряду с другими компонентами почвы (глинами, полуторными оксидами и др.), причем сорбционная способность ГК гораздо выше таковой для минеральных компонентов почвы. Как следствие, из минеральных почв растения поглощают больше тяжелых металлов, чем из богатых органическим веществом, при одинаковом валовом содержании ТМ. С другой стороны, ГФК оказывают влияние на токсичность ТМ в почвенном растворе, переводя их в низкотоксичную закомплексованную форму. Следовательно ГФК участвуют в регулировании соотношения подвижных (доступных растениям) и неподвижных (недоступных растениям) форм тяжелых металлов, воздействуя таким образом на процессы биоаккумуляции и токсические эффекты ТМ [82]. Это свойство ГФК, вероятно, наиболее сильно выражено у обогащенных кислородсодержащими функциональными группами активированных препаратов, такие препараты могут быть использованы для разработки методов детоксикации и рекультивации почв, загрязненных ТМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |