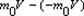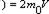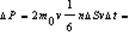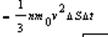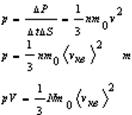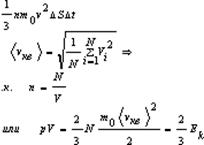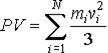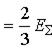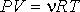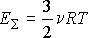Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамический и молекулярно-кинетический методы исследования. Термодинамические параметры. Равновесные состояния и процессы, и их изображения на термодинамических диаграммах.Содержание книги
Поиск на нашем сайте
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики. Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Идея об атомном строении вещества высказана древнегреческим философом Демокритом (460—370 до н. э.). Атомистика возрождается вновь лишь в XVII в. и развивается в работах М. В. Ломоносова, взгляды которого на строение вещества и тепловые явления были близки к современным. Строгое развитие молекулярной теории относится к середине XIX в. и связано с работами немецкого физика Р. Клаузиуса (1822—1888), Дж. Максвелла и Л. Больцмана. Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.). Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул. Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах — фундаментальных законах, установленных в результате обобщения опытных данных. Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет таких областей физики и химии, в которых нельзя было бы пользоваться термодинамическим методом. Однако, с другой стороны, термодинамический метод несколько ограничен: термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.
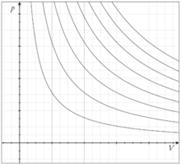
Параметры: температура, давление, плотность, концентрация, мольный объем. Давление – параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой. Температура определяет меру интенсивности теплового движения молекул. Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению). Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры – абсолютный нуль, равный 273,15 оС. Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений · Изотермический процесс, при котором температура системы не изменяется (T=const)
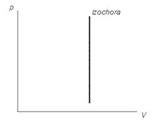
· Изохорный процесс, происходящий при постоянном объёме системы (V=const)
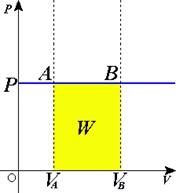
· Изобарный процесс, происходящий при постоянном давлении в системе (P=const)
· Адиабатический процесс происходит в системе без теплообмена с окружающей средой, т. е. dQ = 0
24 вопрос Вывод уравнения молекулярно-кинетической теории идеальных газов для давления и его сравнение с уравнением Клаперона-Менделеева. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.
Вывод уравнения молекулярно-кинетической теории идеальных газов для давления. Выделим на стенке сосуда площадку DS и вычислим давление на эту площадку. При каждом соударении молекула движущаяся перпендикулярно площадке, передаёт ей импульс
где
m0 –масса молекулы, V-скорость молекулы. За время Dt площадки достигнут те молекулы которые заключены в объёме цилиндра с основанием DS и высотой VDt, число этих молекул = nDSvDt. т.к. перпендикулярно пов-сти движется лишь 1/3 молекул, причем по направлению к ней всего 1/6 то
Сравнение уравнения молекулярно-кинетической теории с уравнением Клапейрона-Менделеева уравнение Клапейрона-Менделеева
уравнения молекулярно-кинетической теории
Сравнение выражения (2) с уравнением Клапейрона-Менделеева (1) позволяет сделать вывод, что для идеального газа кинетическая энергия поступательного движения его молекул пропорциональна абсолютной температуре этого газа:
Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.
Средняя квадратичная скорость молекул. Vср.кв.=Ö (3kT/M), где k=1,38× 10-23 - постоянная Больцмана, T - температура. Молекулярно-кинетическое толкование абсолютной температуры. С точки зрения молекулярно-кинетической теории абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекулы. <e пост>=3/2kT.
25 вопрос
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 1653; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.40.234 (0.006 с.) |