
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Организация работы и техника безопасности.Содержание книги
Поиск на нашем сайте
Организация работы и техника безопасности. Приступая к изучению органических соединений, необходимо четко установить правила работы в лаборатории органической химии, знать правила техники безопасности, меры предупреждения и предотвращения несчастных случаев. Помните, что беспорядочность, поспешность, неряшливость могут не только мешать работе, но и привести к несчастным случаям! ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ ОРГАНИЧЕСКОЙ ХИМИИ. 1.1. Во время работы в химической лаборатории соблюдайте чистоту; рационально планируйте свою работу, выполняя ее точно, аккуратно, быстро и без ошибки. 1.2. Не преступайте к выполнению работ без разрешения преподавателя или лаборанта. 1.3. Категорически запрещается работать одному в лаборатории. 1.4. Каждый студент должен работать на закреплённом за ним месте или на специально отведённом для данной работы. 1.5.Содержите рабочий стол в чистоте, не загромождайте его посторонними вещами и предметами. 1.6. Аккуратно и осторожно обращайтесь со стеклянной химической посудой, реактивами и приборами. Во избежание несчастных случаев, из-за возможного выброса реакционной смеси, не заглядывайте в пробирку или колбу сверху. 1.7.Не работайте с грязной посудой и не оставляйте ее немытой после работы. 1.8.Работу с ядовитыми веществами проводите только в вытяжном шкафу. 1.9. Соблюдайте особую меру предосторожности при работе с взрывоопасными легковоспламеняющимися веществами. 1.10.Не выливайте в раковины остатки кислот, щелочей, огнеопасных жидкостей и т.д. Сливайте эти вещества в специальные склянки, расположенные в вытяжном шкафу. Не бросайте в раковины бумагу, песок и другие твердые вещества. 1.11.Не путайте пробки от химических склянок, содержащих разные реактивы, во избежание загрязнения последних. 1.12.Категорически запрещается курить и принимать пищу в лаборатории. 1.13.В лаборатории запрещается хранить верхнюю одежду, работать без спецодежды, загромождать столы, окна и проходы личными посторонними предметами и вещами. 1.14.При возникновении пожара немедленно выключить напряжение во всей лаборатории, уберите из помещения все горючие вещества, засыпьте песок или накройте одеялом очаг пожара и сообщите на кафедру инженеру пожарной охраны о случившемся. Рефлекторно усвойте и без малейших отклонений, соблюдайте все правила противопожарной безопасности. 1.15.Уходя из лаборатории, проверьте, выключены ли газ, приборы, вода и электричество. МЕРЫ ПРЕДОСТОРОЖНОСТИ И ОКАЗАНИЯ ПЕРВОЙ РАБОТА С ЛЕГКОВОСПЛАМЕНЯЮЩИМИСЯ И ВЗРЫВООПАСНЫМИ ВЕЩЕСТВАМИ В органической химии постоянно приходится пользоваться большим арсеналом огнеопасных растворителей, такими как эфиры, спирты, бензол, ацетон и т.п. Работать с этими веществами нужно осторожно, так как их пары могут легко воспламенятся. Необходимо помнить и выполнять следующие требования: 1) Не хранить и не держать эти растворители вблизи огня и нагревательных приборов, в теплом месте. 2) Не нагревайте их на открытом огне различных спиртовок, печек, в открытых сосудах, а только на водяной бане с обратным холодильником. 3) Не выливать в раковину и вообще в канализацию. 4) Не держать на рабочем месте больших их количеств (до 500 мл.). 5) Если в лаборатории по какой-то причине оказалось пролито значительное количество легковоспламеняющейся жидкости, то необходимо выключить общую сеть всех электронагревательных приборов, открыть окна и собрать тряпкой или полотенцем. 2 .3. ПЕРВАЯ ПОМОЩЬ ПРИ ОЖОГАХ, ОТРАВЛЕНИЯХ И ДРУГИХ НЕСЧАСТНЫХ СЛУЧАЯХ. 1) При легких термических ожогах кожу следует обмыть спиртом, а затем смазать глицерином или вазелином. При более сильных ожогах поврежденное место после промывки концентрированным перманганата калия и спиртом необходимо смазать специальной мазью от ожогов или 5-10% синтомициновой эмульсией. 2) При ожогах бромом нужно тщательно промыть обожженное место бензолом, а затем 10% раствором тиосульфата натрия. После вдыхания паров брома следует понюхать разбавленный раствор аммиака и выйти на свежий воздух. 3) При ожогах жидким фенолом необходимо растирать побелевший участок кожи глицерином до тех пор, пока не восстановится нормальный цвет кожи, затем промыть пораненный участок водой и наложить компресс из ваты или марли, обильно смоченной глицерином. 4) При ожогах крепкими щелочами или кислотами, кожу надо промыть током воды (в течение 20-30 минут, а при сильных ожогах 1.5-2 часа). Затем, в случае поражения щелочью, нейтрализовать 1-2 % раствором уксусной или борной кислоты, а в случае попадания кислоты - 3 % бикарбоната натрия. При сильных ожогах кожи кислотами или щелочами после обмывания следует наложить повязку, смоченную раствором марганцовокислого калия или танина. 5) При попадании кислоты или щелочи в глаза нужно промыть их длительное время обильным количеством воды, направляя нерезкую струю прямо в глаза, затем соответственно обработать 3% раствором бикарбоната натрия или насыщенным раствором борной кислоты. Аммиак почти не действует на кожу, однако при попадании в глаза может вызвать сильное повреждение и даже слепоту. 6) При случайном попадании любого реактива внутрь организма рекомендуется выпить больше воды. Наряду с этим необходимо: 6.1. при отравлении кислотами выпить стакан 2% раствора двууглекислой соды; 6.2. при отравлении щелочами выпить стакан 0.2% раствора уксусной или лимонной кислоты; 7) При любом отравлении следует вывести пострадавшего на свежий воздух, при необходимости сделать искусственное дыхание и вызвать врача. 8) При порезах стеклом вынуть осколки и края раны смазать 3% спиртовым раствором йода и наложить стерильную повязку. При сильных кровотечениях наложить выше раны жгут и вызвать врача или доставить пострадавшего в амбулаторию. СОСТАВЛЕНИЯ ОТЧЕТА. Приступая к проведению лабораторных работ, студент должен прежде всегда разобрать по учебникам (или лекционным записям), руководствам, справочной литературе теоретический материал, относящийся к работе. Затем прочитать и самостоятельно усвоить описание работы по данному руководству. Такую работу необходимо проводить не во время занятий в лаборатории, а накануне. Закончив подготовку, нужно продумать правильно ли поняты цели и содержание работы и ясен ли ход предстоящих химических операций. Студент должен отвечать на вопросы преподавателя по изученному материалу. В процессе подготовки и выполнения опыта необходимо составить отчет по каждому опыту и работе в целом. Запись следует начинать с даты, номера и названия работы. Отчет должен содержать кратную запись сущность опыта и химизма реакции с обязательным подписанием под каждой формулой названий веществ. Описывая экспериментальную часть работы, надо остановится на аппаратуре, условиях проведения реакций, провести личные наблюдения (изменение окраски, появления осадка, характерного запаха и т. д.) При этом нужно усвоить, что план работы и описание опыта не должны быть полностью идентичными методике опыта, данного в руководстве. Отчет заканчивается выводами, вытекающими из проделанной работы. Ниже привидится примерный образец записи в рабочей тетради. ОБРАЗЕЦ ЗАПИСИ В РАБОЧЕЙ ТЕТРАДИ Дата…………… Работа№…….. Получение метана. СН3 –СООNa + Na-OH + t º® CH4 +Na 2 CO3 Ацетат натрия метан 2.Химические свойства метана. CH4 +2O2 горение CО2 +2Н2О+О2
СН4 +Вr2 н.у. реакция не идет.
После выполнения всей лабораторной работы и оформление рабочей записи, отчет предоставляется преподавателю на проверку и утверждение.
НОМЕНКЛАТУРА УГЛЕВОДОРОДОВ. Первые четыре парафиновых углеводорода с неразветвленной цепью (нормального строения) имеет тривиальные (случайные, несистематические) названия, в последующих используют в качестве корня число атомов углерода по-гречески, добавляя к ним окончание "ан". Названия радикалов, получающихся при отнятии одного атома водорода от концевого углеродного атома неразветвленных предельных углеводородов, образуются из названий соответствующих углеводородов заменой окончания "ан" на "ил" (таблица I). ТАБЛИЦА І НАЗВАНИЯ АЛКАНОВ И АЛКИЛОВ
Разветвленные радикалы: обозначаются приставкой “изо”;
изопропил изобутил
В названии радикалов широко используется известное понятие о первичных, вторичных, третичных и четвертичных атомах углерода. Как известно, эти обозначения указывают, сколько валентностей потратил данный углеродный атом на связь с другими атомами углерода: первичный – одну, вторичный – две, третичный – три, четвертичный – четыре: С1 1 2 | 4 3 2 1 С - С - С - С - С - С | | С1 С1 Очевидно, что первичные атомы углерода могут находиться только на концах углеродной цели, вторичные - внутри цепи (или цикла), третичные и четвертичные - в местах разветвлений. В зависимости от природы углеродного атома, содержащего свободную валентность, соответственно называются и радикалы:
СН3 –СН2 – СН –СН3 вторичный бутил (втор.-бутил), |
СН3 | СН3 - С - третичный бутил (трет.-бутил). | СН3 Обозначение многих непредельных и ароматических радикалов используется в качестве составных частей названий более сложных органических соединений. Некоторые представители таких радикалов приведены в таблице 2. Таблица 2
Исторически первый тип структурных названий - это рациональные названия - номенклатурное выражение теории типов. Эта номенклатура нагляднее передает строение несложных органических соединений путем сравнения структуры называемого вещества ее со структурой простейшего прототипа, положенного в основу названия. Например: метил СН3 | СН3 – СН2 – С – СН2 – СН3 - диметилдиэтилметан (прототип-метан) этил | этил CH3 метил
Это следует понимать как соединение, у которого «два» (ди)метила, два (ди)этила заместили водороды в первоначальном метане.
СН3- СН=С-СН3 метил - триметилэтилен метил | CH3 метил Три метила заместили водороды этилена (прототип – этилен).
В качестве прототипа обычно применяют первый член гомологического ряда. В названиях ароматических соединений широко применяется понятия "орто" (- о), "мета," (- м) и "пара" (- п) для обозначения взаимного расположения заместителя. В рациональной номенклатуре часто применяются для обозначения положения заместителей буквы греческого алфавита (α,b,g). Например:
В структуре нафталина все положения обозначены таким образом:
β (7) β (2)
β (6) β (3)
α (5) α (4)
Номенклатура систематическая рассматривает каждый углеводород, как состоящий из основной цепи нормального строения и радикалов, замещающих водороды в этой цепи. Обозначение углеродного скелета дает основу названия, наличие кратных связей и заместителей отражается в виде дополнительных суффиксов и префиксов. Любое органическое соединение по этой номенклатуре рассматривается как происходящее от углеводородов. Например, предельные углеводороды имеют суффикс "ан", олефины - "ен", ацетиленовые углеводороды - "ин". Если углеводород имеет несколько двойных связей, то перед суффиксом ставится число этих связей "диен", "триен"» "«тетраен» и т.д. Для обозначения положений двойных и тройных связей или радикалов "основную цепь" нумеруют арабскими цифрами с ближайшего конца от характерной функции и цифру ставят перед названием. Например: 1 2 3 4 5
СН3
СН3 1 2 |3 4 5
СН3 1 2 3 4 5 СН3 - СН = СН – СН2 – СН3 2 – пентен или пентен-2 1 2 3 4 5
СН2-СН3 Цифру, объясняющую положение кратной связи, ставят либо в конце, либо в начале названия основной цепи. 1 2 3 4 5 СН≡С – СН2 – С ≡ СН 1,4 – пентадиин или пентадиин-1,4. В углеводородах, имеющих циклическую структуру, за «основную» цепь избирается одна сама циклическая структура или один из простейших гомологов, например, толуол.
- 1,4-диизопропилбензол . В этом случае нумерация циклической цепи начинает от углерода, связанного с одним из простейших заместителей, или по установленному правилу порядку.
орто-изобутилтолуол (Р).
Положения 1,4,5,8 - α; 2,3,6,7 - b
2-метилфуран 2-метил-3- этилтиофен.
2. НОМЕНКЛАТУРА СОЕДИНЕНИЙ С ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ. Более сложные, чем углеводороды, соединения содержат кроме углерода и водорода другие элемента: кислород, азот, серу, галоген, фосфор и т.д. Эти элементы, образуя функциональные группы, замещают водороды в цепи углеводородов, и образуют новые классы соединений. Каждому классу соединений соответствует своя функциональная группа, например, спиртам и фенолам гидроксильная, альдегидам и кетонам, карбонильная и т.д. К функциональным группам относится металлы, галогены, нитро-, азо-группы, гидроксильная, карбонильная, карбоксильная, аминогруппа и др. Рациональные названия соединений с функциональными группами строятся на основе тех же положений, что и для углеводородов. В качестве прототипов берутся либо первые члены гомологического ряда, метиловый спирт (карбинол); либо простейшие представители гомологического ряда, наиболее полно отражающие химические свойства всех других гомологов, уксусная кислота, уксусный альдегид; либо сама функциональная группа, кетон, амин. Например:
СН3 - СН – ОН карбинол метилэтилкарбинол; Метил
винил | ОН СН3 метил
СН3 – С - метилфенилкетон; метил фенил
Этил О СН3 изопропил
СН3 – NH2 метиламин; метил
этил СН2 – СН3 этил
ОН Систематическая номенклатура строит названия на основе соответствующего углеводорода. Присутствие функциональных групп обозначается: хлор-, нитрозо-(NO), нитро – (NO2) или суффиксами, или префиксами, в зависимости от сложности соединения. В таблице 3 приводятся принятые названия префиксов и суффиксов функциональных основных групп. ТАБЛИЦА 3
Например:
Карбоксильная и альдегидная группы всегда идут под номером «І»
СН3-СН2- СºС-СН2-С 3-гексиналь; ОН
4 3 2 1
СН3 ОН В последнее время цифры при возможности ставятся впереди, освобождая окончание слова. В последующих примерах перемещение цифр привело бы к путанице. 5 4 3 2 1
СН3 О 3-метилпентен-3-он-2; 4 3 2 1 СН3 – СН = СН – СН2 - ОН бутен-2-ол-І или 2-бутенол-І. В соединениях с несколькими функциональными одинаковыми группами перед соответствующими префиксам или суффиксами указывается число этих функциональных групп по-гречески, например: 7 6 5 4 3 2 1
О О
НО ОН
7 6 5 4 3 2 1
ОН СН3 ОН СН3 ОН 2-4-диметил–1,3,5-гептантриол.
1,2,3-триоксибензол. 1,8-диаминонафталин.
При названии соединений с разными функциональными группами вплоть до недавнего времени использовали принципы женевской номенклатуры, обозначая каждую функциональную группу соответствующим суффиксом, например:
ОН 1 2 3 4 5
О ОН В настоящее время предпочитают применять для обозначения одной группы префикс, а для другой – суффикс. Приведенные соединения будут называться соответственно 4-оксибутановая кислота и 3-оксипентанон-2. Приведем еще несколько примеров, используя разные методы: О
ОН Н бутанол-2-аль.
Н СН3 ОН 4-формилпентановая кислота. Начало нумерации углеводородной цепи определяется, так называемым "старшинством группы". Чем выше степень окисления углерода в функциональной группе, тем выше "старшинство группы", тем меньший номер положения в углеродной цепи ей соответствует. В таблице 3 группы по старшинству распределены 4. 2. 3. І. Кроме приведенных номенклатур существуют номенклатуры, специфические для отдельных классов соединений, например, спирты часто называют радикалам: метиловый спирт СН3ОН, изо -пропиловый спирт СН3
СН3 кислоты по углеводородной части молекулы - пропанкарбоновая кислота СН3-СН2 -СООН; или с применением тривиального названия соответствующей кислоты нормального строения, вносятся в качестве префиксов обозначения функциональном группы w-аминокапроновая кислота NH2 –CH2 –(CH2) 4 –COOH, a,b - диоксиянтарная кислота НООС-СНОН-СНОН-СООН; для соединений с функциональными одинаковыми группами расположенными на концах "нормальной" углеводородной цепи применяются названия с перечислением числа метиленовых (-СН2-) и замещающих групп, например: НО – СН2 – СН2 – СН2 – ОН триметиленгликоль; Cl – CH2 – (CH2)2 – CH2 - Cl тетраметилендихлорид; NH2 – CH2 – (CH2)4 – CH2 – NH2 гексаметилендиамин.
В соединениях, которые считается производными соответствующих классов, например, простые и сложные эфира, амиды - широко применяются в виде названий остатки спиртов, аминов, кислот, которые получается при отщеплении водорода или даже гидроксильной группы. Некоторые из применяемых таких названий приведены в таблице 4. Таблица 4 ОПЫТ I. КРИСТАЛЛИЗАЦИЯ. 1/4 объема пробирки заполните водой, добавьте немного (около 0,5 г) бензойной кислоты и нагрейте до кипения. Быстро, не допуская охлаждения раствора, отфильтруйте его от примесей в другую пробирку. Что наблюдается после медленного остывания раствора, а также медленного охлаждения? Выделившиеся кристаллы отфильтруйте и высушите между листочками фильтровальной бумаги. ОПЫТ 2. ВОЗГОНКА. Испытуемое вещество - технический нафталин - поместите в фарфоровую чашку и накройте ее воронкой. Конец воронки заткните ватой. Поставьте чашку на штатив, очень слабо нагрейте ее; по возможности не допуская плавления вещества. Что наблюдается? В конце опыта охладите прибор и, пользуясь стеклянной палочкой, соскоблите чистое вещество с поверхности воронки на бумагу. Сохраните его для опыта 3. Запишите результаты опыта и зарисуйте схему прибора. ОПЫТ 3. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ. На часовое стекло поместите немного испытуемого вещества, разотрите и, прижимая к нему открытый конец капилляра, вдавите в него вещество. Чтобы вещество переместилось на дно капилляра, его бросают запаянным концом в стеклянную трубку, поставленную вертикально на стол. В капилляре должен быть слой вещества высотой 5-8 мм. С помощью специальной лапки прикрепите заполненный капилляр к шарику термометра, вставьте его в прибор для определения температуры плавления и проверьте, чтобы термометр и капилляр не прикасались к стенкам прибора. Нагревайте медленно, со скоростью повышения температуры 1-2 град/мин. При этом непрерывно наблюдайте за веществом в капилляре: появление жидкой капли в нем свидетельствует о начале плавления. При определении температуры плавления неизвестного вещества вначале рекомендуется повышать температуру со скоростью 5-6 град/мин, определить примерную температуру плавления, а затем опыт повторить при медленном повышении температуры. При какой температуре плавятся исходный загрязненный и очищенный нафталин? Как влияет загрязнения и примеси на температуру плавления? Вопросы и упражнения I. Какими методами пользуются для выделения и очистки органических веществ? 2. Как можно определить чистоту полученного вещества? 3. Назовите по ИЮПАК метилэтилпропилтрет.бутилметан. 4. Назовите по ИЮПАК метилдипропилвтор.бутилметан. 5. Назвать по ИЮПАК диэтил- изо -пропилметан. 6. Назвать по ИЮПАК диэтилтрет.бутилметан. 7. Назвать по ИЮПАК диметилдиэтилметан. 8. Назвать по ИЮПАК метилдиэтилтрет.бутилметан. 9. Назвать по ИЮПАК этилвтор.пропилвтор.бутилметан. 10. Назвать по ИЮПАК диметил- изо- пропилметан. 11. Назвать по ИЮПАК диметил- изо -бутилметан. 12. Назвать по ИЮПАК диметилпропил- изо -пропилметан. 13. Назвать по ИЮПАК метилпентаэтилэтан. 14.Назвать по ИЮПАК диметилбутилтрет.бутилметан. 15. Назвать по ИЮПАК этилбутилтрет.бутилметан. 16. Назвать по ИЮПАК триметил- изо -пропилметан. 17. Назвать по ИЮПАК тетраметилметан. 18. Назовите по рациональной номенклатуре 4-метилгептан. 19. Назвать по рациональной номенклатуре 3-этилоктан. 20. Назвать по ИЮПАК изо -бутилацетилен. 21. Назвать по ИЮПАК диэтилацетилен. 22. Назвать по ИЮПАК метилтрет.бутилацетилен. 23. Назвать по ИЮПАК изо -бутилтрет.бутилацетилен. 24. Назвать по ИЮПАК этилацетилен. 25. Назвать по ИЮПАК втор.бутилацетилен. 26. Назовите по рациональной номенклатуре гексин-3. 27. Назовите по ИЮПАК этилтрет.бутилацетилен. 28. Назвать по ИЮПАК изо -бутилтрет.бутилацетилен. 29. Назовите по рациональной номенклатуре бутин-1. 30. Назовите по ИЮПАК изо- пропил- изо -бутилацетилен. 31. Назвать по ИЮПАК пропил- изо -бутилацетилен. 32. Назвать по ИЮПАК ди- изо- пропилацетилен. 33. Назвать по ИЮПАК метил- изо -бутилацетилен. 34. Назвать по ИЮПАК этилвтор.бутилацетилен. 35. Назвать по рациональной номенклатуре бутен-1. 36. Назвать по ИЮПАК симм.этил- изо -пропилэтилен. 37. Назвать по ИЮПАК симм.этил- изо -пропилэтилен. 38. Назвать по ИЮПАК асимм.этил- изо- пропилэтилен. 39. Назвать по ИЮПАК втор.бутилэтилен. 40. Назвать по ИЮПАК симм.вторпропилтрет.бутилэтилен. 41. Назвать по ИЮПАК асимм.метил- изо- пропилэтилен. 42. Назвать по ИЮПАК альфа-метил-бета-этил-альфа- изо- бутилэтилен 43. Назвать по ИЮПАК асимм.метилвтор.бутилэтилен. 44. Назвать по ИЮПАК симм.втор.пропилвторбутилэтилен. 45. Назвать по ИЮПАК триметилэтилен. 46. Назвать по ИЮПАК альфа-бета-диметил-альфа-этилэтилен. 47.Назвать по ИЮПАК альфа-альфа-бета-триметил-бета- изо- пропилэтилен. 48. Назвать по ИЮПАК альфа-бета-диметилтрет.бутилэтилен. 49. Назвать по ИЮПАК симм. дитрет.бутилэтилен. 50.Назвать по ИЮПАК метилдипропилтрет.амилметан. ЛАБОРАТОРНАЯ РАБОТА №2. ВОПРОСЫ И УПРАЖНЕНИЯ. 51. Напишите формулы метилдиэтилметана, метил- изо -пропилметана, ди- изо -прополэтилена, бутилацетилена, метилэтилацетилена, пропилнафталина. 52. Напишите формулы 2,2-диметилпентана, 3-изопропилгексана, 2-метил-2-бутена, 3-этил-1-пентина, 1,2-ди- изо- пропилбензола, 1-метил-5-этилнафталин. Назвать, если возможно, по рациональной номенклатуре. 53. Написать уравнение реакции с серной кислотой для бутана, 1-бутена, метилбензола. 54.Написать реакции присоединения хлора к 2-пентену, 1,4-диэтилбензолу. 55.Написать реакции полимеризации для этилена, пропина, 2-метилстирола, 2-метилбутадиена-1,3. 56.Написать реакцию деполимеризации полиэтилена и поли- изо- бутилена. 57.Какими химическими реакциями можно различить: пропилен и этилацетилен; бутин-1 и бутин-2; диэтилацетилен и пропилацетилен; бутен-1 и бутин-1. 58.Получите по реакции Вюрца: 2,2,3,3-тетраметилбутан; 2,3-диметилбутан; 3,4-диметилгексан; 1,2-диметилциклобутан. 59. Какие продукты могут образоваться на стадии обрыва цепи в реакции хлорирования пропана? 60.Напишите схему реакции, доказывающей СН-кислотность этина. 61.Какие продукты получаются в результате бромирования изо -октана и циклогексана? Объясните механизм и преимущественное направление реакции. 62.Напишите структурную формулу этиленового углеводорода, при озонолизе которого получились такие смеси: метилэтилкетона и пропионового альдегида; ацетона и уксусного альдегида; муравьиный и масляный альдегид. 63.При дегидратации двух изомерных спиртов (С8Н18О) образуется один и тот же этиленовый углеводород. При энергичном окислении последнего получается смесь ацетона и пентановой кислоты. Каковы структурные формулы спиртов? 64.Напишите структурные формулы всех диеновых углеводородов состава С5Н 8. Назовите их по номенклатуре ИЮПАК, к какому типу диенов относится каждый из них? 65.Предложите схемы получения 2,3-диметилбутана из пропана и 2-нитробутана из пропановой кислоты. 66.Гидратацией каких олефинов можно получить диметилэтилкарбинол,2-бутанол, изобутиловый спирт? 67.Сравните отношение гексана и 1-гексена к нагреванию раствором перманганата калия. 68. Какой продукт получается в результате хлорирования при облучении УФ-светом 2-метилпропана, циклогексана, толуола? 69.Напишите реакции гидробромирования и гидратации ацетилена и диметилацетилена. 70.Установите строение соединения С6Н10, если при восстановлении образуется углеводород, при озонолизе которого получается смесь уксусного и изомасляного альдегидов. 71. Приведите качественные реакции на двойную связь. 72. Сравните характер взаимодействия с бромом следующих соединений: СН3–С(СН3)= СН- СН2 –СН3; СН3 –СН(СН3)-СН2 – СН(СН3)- СН3; СН3 –СН(СН3)-СН2- С≡СН. 73.Объясните, какое влияние на направление и скорость электрофильной реакции в бензольном кольце оказывают следующие заместители: -СН3; -С2Н5; -ОН; -С3Н7; -СООН; -SО3Н; -С≡N; -NO2; - NH2; -NHCH3. 74. Напишите реакции алкилирования по Фриделю – Крафтсу; бензола; толуола; нафталина. 75. Напишите реакции хлорирования хлорбензола и 1-метилнафталина. 76. Напишите реакции нитрования бензальдегида, фенола, нафталина, 1-метилнафталина, 2-нафтола. 77. Углеводород С5Н12 в условиях реакции Коновалова превращается в третичное нитропроизводное. Какое строение имеет исходное соединение? 78. Какие свойства бензола отличают его от алкенов и алкинов? Приведите примеры реакций. 79. Напишите схему полимеризации изопрена. 80. Предложите возможные пути синтеза 2-метилпропена. Назовите это соединение по рациональной номенклатуре. 81. Напишите такие реакции: бромирования бензола, фенола, анилина, нитробензола, толуола, 2-метилнафталина. 82. Напишите такие реакции; сульфирования кумола, нафталина, анилина. 83. Напишите такие реакции: нитрования бензола, бензойной кислоты, метоксибензола, нафталина, 2-нафтола. 84. Напишите структурные формулы и определите положение, в котором преимущественно будет протекать бромирование следующих соединений: 2-фторметоксибензол, 1,3-дикарбоксибензол, 4-метиланилин, 4-оксинитробензол. 85. Получите бензол и толуол по схеме: алкан → циклоалкан→ ароматический углеводород. Напишите уравнение реакций. 86. Приведите схемы получения из ацетилена: стирола и этилбензола. 87. Получите из бензола янтарную и адипиновую кислоты. 88. Предложите схемы превращений фенола в полиамидную смолу – капрон. 89. Перечислите критерии ароматичности бензола. 90. Как можно получить бензол из бензоата натрия, фенола, ацетилена, циклогексана, гексана. ЛАБОРАТОРНАЯ РАБОТА №. 3. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ.. Спиртами называются органические соединения, в состав которых входит гидроксильная группа - ОН. По числу гидроксилов, входящих в молекулу, различают одноатомные (алкоголи), двухатомные (гликоли), трехатомные (глицерины) и т. д. спирты. Одноатомные спирты имеют общую формулу R-OH, причем, в зависимости от природы радикалов, бывают предельные, непредельные и ароматические спирты. Если гидроксильная группа связана непосредственно с ароматическим кольцом, то такой спирт называется фенолом. Фенолы также могут быть одно-, двух- и многоатомные. Свойства спиртов определяются как наличием углеродных радикалов (свойства соответствующих углеводородов), так и гидроксильной группой. В этом разделе рассматриваются только свойства гидроксильных групп. Для спиртов характерны реакции замещения только атома углерода в группе –ОН и окисления. Например: 2СН3 –СН2 –СН2 –ОН +2К ® 2СН3 – СН2 –СН2 –ОК +Н2 пропиловый спирт (Т) пропилат калия водород 1-пропанол (С)
Изо -пропиловый спирт (Т) уксусная кислота Изо - |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.184.207 (0.014 с.) |


 метан
метан

 10
10
 - мета-диэтилбензол (прототип–бензол)
- мета-диэтилбензол (прототип–бензол) - α - этилнафталин
- α - этилнафталин α (8) α (1)
α (8) α (1) СН3 - СН – СН2 – СН2 – СН3 2 - метилпентан
СН3 - СН – СН2 – СН2 – СН3 2 - метилпентан СН3 – СН2 – С – СН2 – СН3 3,3 - диметилпентан
СН3 – СН2 – С – СН2 – СН3 3,3 - диметилпентан - этилциклопентан;
- этилциклопентан;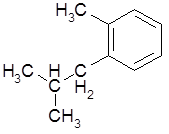 2-изобутилтолуол (С);
2-изобутилтолуол (С);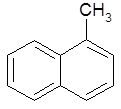 2-метилнафталин (С), β –метилнафталин (Р).
2-метилнафталин (С), β –метилнафталин (Р).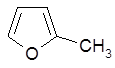

 С2Н5 этил
С2Н5 этил
 О
О СН2 = СН – СН - С метилвинилуксусная кислота;
СН2 = СН – СН - С метилвинилуксусная кислота;
 О
О СН3 – СН2 - С – СН – СН3 этилизопропилкетон
СН3 – СН2 - С – СН – СН3 этилизопропилкетон

 О
О СН3 - - СН2 – С толилуксусная кислота.
СН3 - - СН2 – С толилуксусная кислота.

 5 4 3 2 1 О
5 4 3 2 1 О СН3-СН-СН2- СН2-С 4-метилпентановая кислота. СН3 ОН
СН3-СН-СН2- СН2-С 4-метилпентановая кислота. СН3 ОН 6 5 4 3 2 1 О
6 5 4 3 2 1 О СН3-СН-СН-СН3 3-метилбутанол-2 или 3-метил-2-бутанол.
СН3-СН-СН-СН3 3-метилбутанол-2 или 3-метил-2-бутанол. СН3 –СН=С – С - СН3
СН3 –СН=С – С - СН3
 СН3 – С – СН2 – СН2 – СН2 – С – СН3 2,6 – гептадион.
СН3 – С – СН2 – СН2 – СН2 – С – СН3 2,6 – гептадион.


 О 6 5 4 3 2 1 О
О 6 5 4 3 2 1 О
 С – СН2 – С º С – СН2 – С 3-гексиндионовая кислота.
С – СН2 – С º С – СН2 – С 3-гексиндионовая кислота.

 НО – СН2 – СН2 – СН2 – С бутанол-4-овая кислота.
НО – СН2 – СН2 – СН2 – С бутанол-4-овая кислота.




 О О
О О
 С – СН – СН2 – СН2 – С 4-метилпентанальовая кислота;
С – СН – СН2 – СН2 – С 4-метилпентанальовая кислота; СН –ОН;
СН –ОН;



 СН3 О СН3 О
СН3 О СН3 О


 СН – ОН + СН3 - С -Н2О СН – О – С – СН3 СН3 ОН СН3
СН – ОН + СН3 - С -Н2О СН – О – С – СН3 СН3 ОН СН3


