Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опытное обоснование основных положений молекулярно-кинетической теории строения вещества. Масса и размеры молекулСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
План ответа 1. Основные положения. 2. Опытные доказательства. 3. Микрохарактеристики вещества.
Молекулярно-кинетическая теория (МКТ) — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения: 1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов. 2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества. 3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними. Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения — уменьшение температуры. Массы молекул очень малы, и удобно использовать не абсолютные значения масс, а относительные. Относительные массы атомов и молекул были определены еще очень давно. Относительные атомные массы всех химических элементов указаны в таблице Менделеева. Физическими методами, например по движению ионов в электрическом и магнитном полях, удалось определить массы некоторых атомов в абсолютных единицах. Так появилась атомная единица массы (а. е. м..), равная 1/12 массы атома углерода. Итак, 1 а. е. м. = 1,66 • 10-27 кг. Поскольку относительная молекулярная масса Мr— это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода, то относительная молекулярная масса позволяет найти массу любой молекулы или атома Например, для воды (Н20) Мr = 18 и масса молекулы воды равна т0 = 29,88 • 10-27 кг. Диаметром молекулы принято считать минимальное расстояние, на которое им позволяют сблизиться силы отталкивания. Однако понятие размера молекулы является условным. Средний размер молекул порядка 10-10 м. Многие свойства вещества определяются только числом частиц, но не зависят от свойств частиц. Например, давление идеального газа определяется концентрацией частиц п и температурой Т: р = nkT; сила тока через проводник также зависит от свойств носителей заряда: I = Nq0vS, где п — концентрация свободных частиц, q0— заряд одной частицы, v— ско-РООТЬ частиц, S — площадь поперечного сечения про-водника. Именно поэтому возникло в физике понятие Количество вещества. Единица количества вещества определяется на основе соотношения для расчета числа частиц N в веществе любой массы. Действительно, формулы следует, что в образце, масса которого m численно равна Mr, число частиц равно
Число частиц в одном моле вещества названо числом Авогадро. Итак, NA = 6,02 • 1023 1/моль, в одном моле любого вещества содержится NA частиц. Теперь можно найти массу одного моля М. Эта величина называется молярной массой. Действительно, по определению
Из формулы М = m0NAследует, что единица молярной массы вещества - кг/моль
Билет № 7
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.232 (0.006 с.) |

 атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.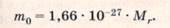
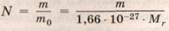 . Из этой
. Из этой
 При переходе к СИ было взято в качестве единицы количества вещества число в 103 раз меньшее, т. е. N = 6,02 • 1023. Эта единица называется моль.
При переходе к СИ было взято в качестве единицы количества вещества число в 103 раз меньшее, т. е. N = 6,02 • 1023. Эта единица называется моль.