Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Использование ручной лупы и микроскопаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Научные методы исследования Цель: ознакомиться с научными методами исследования, применяемыми в биологии для изучения физиологических процессов, протекающих в организме Оборудование и материалы: лупа, микроскоп стереоскопический МБС – 10, Теоретические сведения Науку можно определить как знание или как метод. Научные знания - это совокупность фактической информации о материальном мире, накопленная посредством научного метода. «Наука едва ли не целиком есть результат интеллектуальной любознательности». Чтобы удовлетворить собственную любознательность, ученые должны постоянно ставить вопросы, касающиеся устройства окружающего нас мира, и находить верные ответы. В этом залог успеха науки. «Сформулировать проблему часто бывает важнее, чем найти ее решение, которое нередко зависит от умения пользоваться математическим аппаратом и опыта экспериментатора. Умение ставить новые вопросы, видеть новые возможности, рассматривать старые проблемы под новым углом зрения требует творческого воображения и приводит к подлинным успехам в науке». Альберт Эйнштейн Научная работа может явиться продолжением уже сделанных наблюдений или может быть следствием некоего внутреннего «индуктивного» процесса, происходящего в умах ученых. Истинно научные утверждения, как подчеркивает современный гносеолог Карл Поппер, должны быть в принципе опровержимыми. Это означает, что данные должны быть доступны для проверки и воспроизведения другими исследователями. Поэтому очень важно, чтобы все научные исследования были полностью и ясно описаны. Если при повторных исследованиях в одинаковых условиях получены одинаковые результаты, то их можно признать достоверными. Знания, которые невозможно проверить, таким образом, относятся к разряду «метафизических», а не научных. Факты основываются на прямых или косвенных наблюдениях, выполненных с помощью органов чувств или приборов, действующих как усилители наших чувств. К таким приборам относят, например, свето- или радиотелескопы, световые и электронные микроскопы, осциллографы. Все факты, относящиеся к конкретной проблеме, называются данными. Наблюдения могут быть качественными (т.е. описывать цвет, форму, вкус, внешний вид и т.д.) или количественными. Количественные наблюдения являются более точными. Они включают измерение величины или количества, наглядным выражением которых могут служить качественные признаки. В результате наблюдений получают так называемый «сырой материал», на основе которого формулируется гипотеза (рис. П.2.1). Гипотеза - это основанное на наблюдениях предположение, с помощью которого можно дать убедительное объяснение наблюдаемых явлений. Эйнштейн подчеркивал, что гипотеза выполняет две функции: 1)Она должна объяснять все наблюдаемые явления, относящиеся к данной проблеме. 2)Она должна вести к предсказанию новых знаний. Новые наблюдения (факты, данные), подтверждающие гипотезу, будут способствовать ее упрочению, тогда как наблюдения, противоречащие гипотезе, должны привести к ее изменению или даже к отказу от нее.
Рис. 1. Схематичное изображение научного метода.
Для того чтобы оценить обоснованность гипотезы, необходимо запланировать серию экспериментов с целью получения новых результатов, подтверждающих или противоречащих гипотезе. В большинстве гипотез обсуждается ряд факторов, которые могли бы повлиять на результаты научных наблюдений; эти факторы называются переменными. Гипотезы можно объективно проверить в серии экспериментов, в ходе которых поочередно исключается по одной из предполагаемых переменных, влияющих на результаты научных наблюдений. Указанная серия экспериментов называется контрольной. Этим обеспечивается то, что в каждом конкретном случае проверяется влияние только одной переменной. Наиболее удачная гипотеза становится рабочей гипотезой, и если она способна устоять при попытках ее опровержения и по-прежнему удачно предсказывает ранее необъясненные факты и взаимосвязи, то она может стать теорией. Общее направление научного исследования состоит в достижении более высоких уровней предсказуемости (вероятности). Если теорию не способны изменить никакие факты, а встречающиеся от нее отклонения регулярны и предсказуемы, то ее можно возвести в ранг закона. По мере увеличения совокупности знаний и совершенствования методов исследования гипотезы и даже прочно укоренившиеся теории могут оспариваться, видоизменяться и даже отвергаться. Научные знания по своей природе динамичны и рождаются в процессе полемики, а достоверность научных методов постоянно подвергается сомнению. Рисунки Цель применения рисунков: 1. Документировать результаты работы для использования их в дальнейшем. 2. Дополнить визуальное наблюдение и дать возможность увидеть исследуемый объект более полно и точно. 3. Способствовать запоминанию, зарисовывая то, что вы видите. Правила выполнения рисунков: 1. Необходимо пользоваться тетрадью или бумагой для рисования соответствующей толщины и качества. С нее должны хорошо стираться карандашные линии. 2. Карандаши должны быть острыми, твердости НВ, не цветными. 3. Рисунок должен быть: а) достаточно крупным, чем больше элементов составляют исследуемый объект, тем крупнее должен быть рисунок; б) простым, включать очертания структуры и других важных деталей, чтобы показать расположение и связь отдельных элементов; в) тщательно выполненным, и если объект имеет несколько сходных частей, необходимо точно вырисовывать их мелкие детали; г) нарисован тонкими и отчетливыми линиями - каждую линию необходимо продумать и затем нарисовать без отрыва карандаша от бумаги; не штриховать и не раскрашивать; д) надписи должны быть по возможности полными, идущие от них линии не должны пересекаться; оставляйте вокруг рисунка место для надписей. 4. Делать при необходимости два рисунка: а) схематичный рисунок, показывающий основные черты, и б) только детали мелких частей. Например, при малом увеличении нарисовать план поперечного сечения органа или сосуда и при большом увеличении - детальное строение клеток (крупно нарисованную часть рисунка обводят на плане клином или квадратом). 5. Рисовать следует только то, что вы действительно видите, а не то, что вам кажется, что вы видите, и, конечно же, не копировать рисунок из книги. 6.
Рис. 2. Виды сечений в биологических рисунках: А - поперечные сечения; Б - продольные сечения. 7. При зарисовке приборов необходимо нарисовать вертикальный разрез и на нем ясно показать трубки и клапаны, через которые из сосудов могут выходить газы.
Микроскопические методы Подготовка материала для работы с микроскопом Биологические объекты можно исследовать как живыми, так и фиксированными. В последнем случае материал для более детального изучения можно разделить на части и обработать рядом различных красителей, для того чтобы выявить и идентифицировать различные структуры. Из исследуемого объекта можно приготовить временные или постоянные препараты. Постоянные препараты 1. Фиксация - это сохранение материала в состоянии, близком к естественному. Для фиксации необходимо быстро умертвить ткани. Это лучше достигается при работе с небольшими кусочками живого материала. Используемое для этого вещество называется фиксатором. Быстрой фиксацией обеспечивается сохранение изначальной структуры объекта, причем ткани уплотняются настолько, что с них можно готовить тонкие срезы. 2. Обезвоживание. Обезвоживание проводится при подготовке материала к заливке или для заключения его в соответствующую среду, которая не смешивается с водой. Воду необходимо удалить также потому, что иначе со временем препарат будет разрушен бактериями. Для того чтобы сохранить ультраструктуру, обезвоживание надо проводить постепенно, обрабатывая материал рядом водных растворов этанола или пропанона (ацетона) со все возрастающей концентрацией, и закончить обработку «абсолютным» (чистым) этанолом или пропаноном. 3. Просветление. Некоторые из общеупотребимых сред для заливки и заключения не смешиваются со спиртом. Поэтому его надо постепенно замещать средой (просветляющее вещество), с которой заливочная среда смешивается, например ксилолом. Это приводит также к тому, что материал становится прозрачным. 4. Заливка. Для того чтобы с помощью микротома получить очень тонкий срез, необходимо, чтобы материал был залит в определенную среду. При приготовлении препаратов для световой микроскопии объекты заливают в парафин, которому затем дают застыть. При приготовлении препаратов для электронной микроскопии необходимо использовать более твердые вещества (пластмассы или смолы), потому что необходимые в этом случае более тонкие срезы требуют для своего приготовления более плотные вещества. 5. Изготовление срезов. Как правило, толщина кусочков материала слишком велика, чтобы сквозь них могло пройти достаточное для исследования под микроскопом количество света. Обычно приходится срезать очень тонкий слой исследуемого материала, т. е. готовить срезы. Срезы можно делать бритвой или на микротоме. Вручную срезы готовятся с помощью остро отточенной бритвы. Для работы на обычном микроскопе толщина среза должна равняться 8-12 мкм. Ткань следует закрепить между двумя кусочками сердцевины бузины. Бритву смачивают жидкостью, в которой хранилась ткань; срез делают через бузину и ткань, причем бритву держат горизонтально и двигают ее к себе медленным скользящим движением, направленным чуть вкось. Быстро сделав несколько срезов, следует выбрать из них самый тонкий, содержащий характерные ткани. Срез с ткани, залитой в ту или иную среду, можно сделать на микротоме. Для светового микроскопа срезы толщиной в несколько микрометров можно сделать с залитой в парафин ткани с помощью специального стального ножа. На ультратоме изготавливают чрезвычайно тонкие срезы (20-100 нм) для электронного микроскопа. Для этого необходим алмазный или стеклянный нож. Срезы для светового микроскопа можно приготовить, не заливая материал в среду; для этого используют замораживающий микротом. В процессе приготовления замороженного среза образец сохраняется в замороженном и, следовательно, в твердом состоянии. 6. Окрашивание. Как правило, биологические структуры на препаратах прозрачны, поэтому для получения контраста между ними приходится прибегать к различным средствам. Самым распространенным является окрашивание. Некоторые красители, используемые в световой микроскопии, перечислены в табл. 2. Определенные красители при использовании их в низких концентрациях не токсичны для живых тканей и поэтому могут применяться для окрашивания живых организмов. Они называются прижизненными (витальными) красителями. К ним относятся такие, как метиленовый синий и нейтральный красный. При окрашивании парафиновых срезов парафин удаляют с помощью растворителя, а срез частично обводняют перед окрашиванием.
Таблица 2. Красители, применяемые для окраски растительных и животных тканей
7. Заключение. Полностью окрашенные срезы заключают на предметном стекле в специальную среду, например в канадский бальзам или эупарол, которая не пропускает воздух и способна неограниченно долго сохранять срез. Заключенный в среду срез покрывают покровным стеклом. Последовательность описанных выше действий является типичной при приготовлении тонких срезов для постоянных препаратов. Однако часто в порядок действий вносят два следующих изменения: а) если срез сырого материала готовится вручную, то сначала делают срез, а потом фиксируют его; б) окрашивать можно после фиксации или же в процессе обезвоживания на какой-либо ее стадии. Например, красителем, растворенным в 50% эта ноле, можно окрасить срез после его дегидратации в 50% этаноле. Описанная процедура приготовления препаратов в основном сходна как для светового, так и для электронного микроскопов, хотя существуют некоторые различия в деталях (они отмечены в табл. 3). Таблица 3. Различия в подготовке материалов для светового и электронного микроскопов
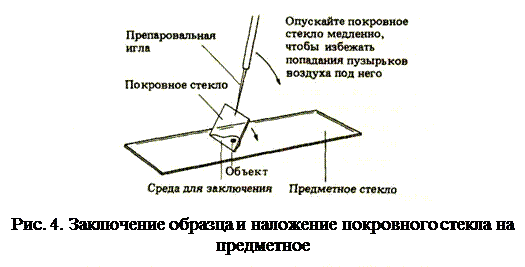
Временные препараты Временные препараты для светового микроскопа в отличие от постоянных можно сделать сравнительно быстро. Они готовятся для проведения быстрых предварительных исследований. Для этого материал фиксируют, окрашивают и заключают в среду. Срезы можно приготовить до фиксации или мацерации (древесину, например, мацерируют). Срез свежего материала можно сделать вручную с помощью бритвы непосредственно в 70% спирте, который служит фиксатором. Для окрашивания и заключения можно использовать ряд временных красителей; некоторые из них, пригодные для окрашивания растительного материала, приведены в табл. 2. Каждый срез следует помещать на чистое предметное стекло (предварительно протертое спиртом) и капнуть несколько капель красителя. При окрашивании флороглюцинолом добавляется также одна капля концентрированной соляной кислоты. Затем препарат покрывают тонким покровным стеклом, чтобы предотвратить попадание воздуха и пыли и предохранить от загрязнения объектив большого увеличения (рис. 4). Если образец начнет подсыхать или если заранее известно, что потребуется длительное изучение (более 10 мин), то после окрашивания препарат следует заключить в глицерин.
Электронный микроскоп Разрешающая способность светового микроскопа ограничена длиной световых волн. Максимально возможное разрешение равно половине длины волны используемого света. Получить изображение объекта размером меньше, чем эта величина, невозможно. Средняя длина волны видимого света составляет примерно 550 нм, поэтому в конце XIX в. могли получить разрешение примерно в 200 нм. Незначительное увеличение разрешающей способности было достигнуто благодаря использованию специально сконструированного микроскопа с ультрафиолетовым светом (длина волны которого составляет 250 нм), обеспечивающим разрешение примерно в 100 нм. Однако многие клеточные структуры имеют меньший размер. Эта проблема была решена в тридцатые-сороковые годы, когда создание электронного микроскопа произвело революцию в биологической науке. Вместо светового излучения в электронном микроскопе используют пучок электронов, у которых длина волны значительно меньше и, следовательно, с намного большей разрешающей способностью. Длина волны электронов зависит от напряжения, подаваемого для генерации электронного пучка, но практически можно получить разрешение приблизительно в 0,5 нм, т.е. примерно в 500 раз больше, чем в световом микроскопе. Создаваемое увеличение достаточно, чтобы различить крупные молекулы. Лимитирующим фактором в достижении большего увеличения стало (и остается до сих пор) не усиление разрешающей способности микроскопа, а методы подготовки материала для исследования. В сущности принцип действия электронного микроскопа такой же, как и светового микроскопа, в котором пучок световых лучей направляется линзой конденсора через образец, а полученное изображение затем, увеличивается с помощью линз. В табл. 4 суммированы некоторые сходства и различия между этими микроскопами. Запомните также, что принципы подготовки материала для электронной и световой микроскопии примерно одинаковы, хотя имеются и важные различия (табл. 3). Оператор сидит у пульта управления лицом к колонне, по которой проходит пучок электронов (рис. 5). Электронный микроскоп перевернут «вверх дном» по сравнению со световым микроскопом. Здесь источник электронов находится в верхней части колонны, а сам образец - внизу (рис. 6). На вольфрамовую нить накала, находящуюся в верхней части колонны, подается высокое напряжение (например 50000 В), и нить накала излучает поток электронов. Чтобы сфокусировать эти электроны (изменить их траекторию), необходимы уже не стеклянные линзы, а электромагниты. Внутри колонны создается глубокий вакуум, чтобы сократить до минимума рассеивание электронов из-за столкновения с частицами воздуха и происходящее в результате этого нагревание. Таблица 4. Сравнение светового и электронного микроскопов
В трансмиссионном (просвечивающем) электронном микроскопе электроны проходят через образец, поэтому для изучения можно использовать только очень тонкие срезы или частицы, так как электроны легко рассеиваются или поглощаются исследуемым объектом. Части образца с относительно высокой молекулярной массой в наибольшей степени вызывают рассеивание электронов, поэтому при окрашивании образца с целью увеличения контраста используются тяжелые металлы, такие, как свинец или уран. Образец обычно удерживается на маленькой медной сетке (примерно 2 мм в диаметре), которую иногда для большей прочности покрывают тонкой пластмассовой пленкой. Пройдя через образец, электроны собираются и фокусируются добавочными электромагнитными линзами. Электроны невидимы для человеческого глаза, поэтому они направляются или на флуоресцентный экран, который воспроизводит видимое изображение, или же непосредственно на фотопленку, чтобы получить постоянный фотоснимок (электронную микрофотографию).
Рис. 5. Современный трансмиссионный электронный микроскоп.
Рис. 6. Траектория пучка электронов в трансмиссионном электронном микроскопе.
Для подготовки материала к исследованию используют различные приемы, но в любом случае материал должен быть мертвым, так как в процессе наблюдения он находится в вакууме, быстро нагревается и начинает разрушаться под действием пучка электронов. Фотографировать необходимо для регистрации информации в том случае, если требуется длительное изучение образца. Приемы подготовки материала к исследованию: 1. Окрашивание ультратонких срезов тяжелыми металлами. Срезы готовятся на ультратоме и окрашиваются соединениями тяжелых металлов, такими, как нитрат свинца, уранилацетат или осмиевая кислота. Окрашенные участки становятся малопроницаемыми для электронов, и, таким образом, на микрофотографиях они выглядят темными. 2. Негативное контрастирование. При негативном контрастировании окрашивается фон, тогда как сам образец остается неокрашенным. Этот метод особенно удобен при изучении деталей строения поверхности мелких частиц, таких, как рибосомы, вирусы и фрагменты изолированных органелл и мембран, так как краситель проникает между деталями поверхностного строения. 3. Напыление. Образец бомбардируется атомами тяжелых металлов, например золотом или платиной, в определенном направлении или под определенным углом. Поверхность образца покрывается слоем металла, непроницаемого для электронов. Закрытые площади, в том числе «тень» за образцом, не покрываются металлом и остаются относительно прозрачными для электронов. Они дают белый цвет (пропускают электроны, которые равнозначны свету). Так как человеческий глаз лучше воспринимает и интерпретирует темные отпечатки, обычно печатают негативы фотографий. Напыление используют также, чтобы выявить структуру поверхности мелких частиц, например вирусов. 4. Замораживание - скалывание и замораживание - травление. Фрагмент ткани быстро замораживается при очень низкой температуре и затем разламывается с помощью очень острого металлического лезвия. Ткань трескается вдоль слабо соединенных плоскостей, которыми часто являются мембраны (рис. 7). Образец выдерживают на холоде в глубоком вакууме; в этих условиях лед возгоняется, оставляя сколотую поверхность.
Рис. 7. А. Схематическое изображение метода замораживания - скалывания. Б. Обнажение клеточных мембран в процессе скалывания.
Этот метод очень удобен при изучении структуры мембраны. Его преимущество состоит в том, что живые ткани быстро умерщвляются, не подвергаясь химической обработке, которая может повлиять на их структуру. Вполне вероятно, что такие клетки сохраняют свою прижизненную форму; тем самым подтверждаются данные, полученные с помощью общепринятых гистологических методик. Представление данных После проведения качественных и количественных исследований получают определенные результаты в виде описательных и численных данных. Чтобы получить максимальное количество информации, необходимо тщательно спланировать исследование, а полученные данные всесторонне обработать и внимательно проанализировать. Составление таблиц Таблицы относятся к наиболее простому способу представления данных. Они состоят из колонок со значениями двух или более связанных переменных. С помощью этого метода трудно получить прямое и ясное указание на связь между переменными, но он часто является первым этапом регистрации информации и служит основой для выбора последующей формы графического представления данных. Распределение частот Существует множество отношений между переменными, при которых каждое значение зависимой переменной, соответствующее значению независимой переменной, представляет собой число событий, приходящихся на данное значение независимой переменной, т.е. ее частоту. Такие отношения можно описать функцией распределения частот, или просто распределением, например, мальчиков по росту в группе. Если независимая переменная может принимать любые значения в пределах данного ряда, то распределение частот можно представить в виде обычного графика, как это описано выше. Такие графики называются кривыми распределения и в зависимости от рода данных могут иметь одну из форм, описанных ниже. Если данные представляют собой численность организмов в пределах определенного интервала, как показано на рис. 10, А, то распределение называется непрерывным, а все пространство под кривой составляет общую частоту событий. 1. Кривая нормального распределения. В этом случае распределение частот симметрично относительно центрального значения, а рассматриваемые переменные относятся к физическим параметрам, таким, как рост или масса биологического объекта. Этот тип распределения показан на рис. 10. 2. Положительный уклон. Кривая распределения в этом случае несимметрична. Наибольшие частоты независимой переменной приходятся на ее более низкие значения, а по направлению к более высоким значениям кривая начинает «хвостить» (рис. 11, А). В качестве примера такого распределения можно привести распределение числа детей, приходящихся на одну семью, размеров кладки у птиц, плотности фитопланктона с увеличением глубины. 3. Отрицательный уклон. В этом случае наибольшие частоты независимой переменной приходятся на ее более высокие значения, а по направлению к более низким значениям кривая начинает «хвостить» (рис. 11, Б). Эта форма распределения встречается реже, чем предыдущая; она характерна для распределения некоторых форм смещения. Например, распределение оптимальных температур ферментативных реакций и выработка стимулирующих гормонов щитовидной железы в ответ на действие тироксина. 4. Бимодальное распределение. В этом случае наблюдаются два максимума (или два пика), что обычно указывает на присутствие двух популяций, для каждой из которых характерно неполное нормальное распределение. 5. Совокупное распределение частот. Данные, представленные на рис. 10, можно также представить, как на рис. 12. Здесь показано совокупное число организмов, находящихся ниже определенного произвольно выбранного класса границ. Если эти данные изобразить графически, то получится кривая совокупного распределения частот.
Рис. 10. А. Представленная в виде таблицы численность 18-летних мужчин в каждом классе массы по 2 кг. Б. Графическое изображение данных из табл. А. дает кривую нормального распределения.
Рис. 11. А Распределение с положительным уклоном. Б. Распределение с отрицательным уклоном.
Рис. 12. Таблица (А) и график (Б), построенные на основе рис. 10, А, представляющие совокупную частоту распределения массы среди 18-летних мужчин.
Если независимая переменная принимает дискретные значения, например целые числа 3 и 5 (как число лепестков у двудольных), или ею представлены физические признаки, такие, например, как группы крови, которые характеризуются дискретными значениями, то распределение не будет непрерывным. В этом случае нельзя начертить непрерывную кривую, поэтому используются другие, описанные ниже формы графического изображения данных. 1. Диаграмма в виде вертикальных столбцов. Она показывает частоту, с которой определенные признаки встречаются внутри популяции. Например, частота групп крови у человека (см. рис. 13, А). 2. Гистограмма. Она строится на непрерывных значениях независимой переменной, сгруппированных в классы равной ширины. Когда классы равной ширины выбраны, например 0-5, 5-10, 10-15 и т.д., границы интервалов обычно проходят по числам меньшим, чем указанные целые значения, т.е. 0-4,99; 5-9,99; 3. Диаграмма в виде горизонтальных столбцов. Это видоизмененная форма гистограммы. Она обычно используется для того, чтобы показать отношения между непрерывной зависимой переменной, например содержанием энергии, и нечисловой независимой переменной, например различными видами пищи (рис. 13, В). Видоизмененная форма горизонтальной диаграммы используется для представления экологических данных; она называется диаграммой присутствия-отсутствия.
Рис. 13. Способы представления данных. А. Диаграмма с вертикальным расположением столбцов, показывающая фенотипы пол группам крови в популяции. Б. Гистограмма, показывающая частоту различного систолического кровяного давления у женщин в возрасте от 30 до 39 лет. В. Диаграмма с горизонтальным расположением столбцов, показывающая содержание энергии в пище (при трехразовом питании).
4. Кайт-диаграмма. Это особый тип горизонтальной диаграммы, который дает предельно ясное наглядное изображение изменения частот неисчисляемых переменных непрерывно распределенных в пределах определенной площади. Кайт - диаграмма строится путем нанесения частот каждой переменной в виде параллельных отрезков, перпендикулярных оси х (рис. 14, А). После того как все частоты нанесены вдоль оси х, соседние концы отрезков соединяются прямыми линиями как при построении линейного графика (рис. 14, Б). Заключенную внутрь фигуры площадь обычно заштриховывают, чтобы получить более наглядное изображение. Каждый из описанных выше способов представления данных используется при решении различных биологических задач. Каждый метод имеет свои достоинства. При выборе того или иного метода следует руководствоваться тем, как можно наиболее точно и рационально продемонстрировать связи и характер отношений между переменными.
Научные методы исследования Цель: ознакомиться с научными методами исследования, применяемыми в биологии для изучения физиологических процессов, протекающих в организме Оборудование и материалы: лупа, микроскоп стереоскопический МБС – 10, Теоретические сведения Науку можно определить как знание или как метод. Научные знания - это совокупность фактической информации о материальном мире, накопленная посредством научного метода. «Наука едва ли не целиком есть результат интеллектуальной любознательности». Чтобы удовлетворить собственную любознательность, ученые должны постоянно ставить вопросы, касающиеся устройства окружающего нас мира, и находить верные ответы. В этом залог успеха науки. «Сформулировать проблему часто бывает важнее, чем найти ее решение, которое нередко зависит от умения пользоваться математическим аппаратом и опыта экспериментатора. Умение ставить новые вопросы, видеть новые возможности, рассматривать старые проблемы под новым углом зрения требует творческого воображения и приводит к подлинным успехам в науке». Альберт Эйнштейн Научная работа может явиться продолжением уже сделанных наблюдений или может быть следствием некоего внутреннего «индуктивного» процесса, происходящего в умах ученых. Истинно научные утверждения, как подчеркивает современный гносеолог Карл Поппер, должны быть в принципе опровержимыми. Это означает, что данные должны быть доступны для проверки и воспроизведения другими исследователями. Поэтому очень важно, чтобы все научные исследования были полностью и ясно описаны. Если при повторных исследованиях в одинаковых условиях получены одинаковые результаты, то их можно признать достоверными. Знания, которые невозможно проверить, таким образом, относятся к разряду «метафизических», а не научных. Факты основываются на прямых или косвенных наблюдениях, выполненных с помощью органов чувств или приборов, действующих как усилители наших чувств. К таким приборам относят, например, свето- или радиотелескопы, световые и электронные микроскопы, осциллографы. Все факты, относящиеся к конкретной проблеме, называются данными. Наблюдения могут быть качественными (т.е. описывать цвет, форму, вкус, внешний вид и т.д.) или количественными. Количественные наблюдения являются более точными. Они включают измерение величины или количества, наглядным выражением которых могут служить качественные признаки. В результате наблюдений получают так называемый «сырой материал», на основе которого формулируется гипотеза (рис. П.2.1). Гипотеза - это основанное на наблюдениях предположение, с
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 508; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.02 с.) |


 Каждый рисунок должен иметь название, указание об увеличении и о проекции образца (например, ПС, ПрС и т.д.) и объяснительную записку (рис. 2).
Каждый рисунок должен иметь название, указание об увеличении и о проекции образца (например, ПС, ПрС и т.д.) и объяснительную записку (рис. 2).