
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні поняття органічної хімії.Содержание книги Поиск на нашем сайте
Самостійна робота №1 Основні поняття органічної хімії. Насичені вуглеводні. 1. Скласти конспект з питань: – типи розриву зв’язків; – типи реагентів.
2. Скласти рівняння реакцій, що підтверджують хімічні властивості: – н –пентану; – 2,3 – диметилбутану; – 2,2 – диметилпропану; – циклобутану; – циклопентану.
3. Заповнити таблицю:
Зміст теми: Типи розриву зв’язків · гомолітичний розрив (радикальний):
Утворюються вільні радикали.
H H
H H · гетеролітичний розрив (іонний):
Утворюються іони.
Типи реагентів · радикали – частинки з неспареним електроном (не мають заряду): Cl · Н3С· · електрофіли – це позитивні іони та нейтральні частинки, що мають вільну орбіталь: Н+ NO2+ CH3+ · нуклеофіли – це негативні іони або нейтральні молекули, що мають пару електронів на зовнішньому рівні: Cl – ОН– Н2О:: NН3 Використання алканів та циклоалканів у медицині Вазелінова олія – суміш рідких вуглеводнів, в молекулах яких до 15 атомів С. Основа для виготовлення мазей. Вазелін – суміш рідких та твердих вуглеводнів, в молекулах яких до 25 атомів С. Основа для виготовлення мазей. Парафін – суміш твердих вуглеводнів (до 40 атомів С). Використовують для теплових процедур. Озокерит – суміш твердих вуглеводнів (більше 40 атомів С). Використовують для теплових процедур.
Самостійна робота №2 Ненасичені вуглеводні
1. Скласти рівняння реакцій, що підтверджують хімічні властивості: – 1 – бутену; – 2 – бутену; – пропіну.
2. Скласти рівняння реакцій добування: – пропену; – 1 – бутену; – 2 – бутену. 3. Заповнити таблицю: Розпізнавання алканів, алкенів, алкінів
4. Здійснити перетворення:
Самостійна робота №3 Ароматичні вуглеводні
1. Скласти рівняння реакцій, що підтверджують хімічні властивості: – етилбензолу; – пропілбензолу; – ізопропілбензолу (кумолу); – мета – ксилолу. 2. Заповнити таблицю: Розпізнавання бензолу, толуолу, стиролу
3. Здійснити перетворення:
4. Заповнити таблицю: Порівняльна характеристика вуглеводнів
Самостійна робота №4 Галогенопохідні вуглеводнів
– хлоретану; – 1,2 – дихлоретану; – 1,1 – дихлоретану; – хлорбензолу; – 1,3 – дихлорпропану. 2. Скласти рівняння реакцій добування: – хлоретану (з відповідного алкану, алкену, спирту); – 1,1 – дихлорбутану (з відповідного альдегіду); – 2,2 – дихлорбутану (з відповідного кетону, алкану, алкіну); – 1,2 – дихлорбутану (з відповідного алкену, спирту). 3. Здійснити перетворення: гептан → толуол → хлорметилбензол → 1,2 – дифенілетан 4. Заповнити таблицю:
Використання галогенопохідних у медицині
Хлороформ СНCl3 – інгаляційний наркоз. Йодоформ СНІ3 – антисептичний засіб. Хлоретан С2Н5Cl – місцевий знеболюючий засіб. Його дія зумовлена швидким випаровуванням, що викликає сильне охолодження шкіри і втрату чутливості. Сl ׀ Фторотан F3C – CH – інгаляційний наркоз. ׀ Br Трихлоретилен ClHC = CCl2 – інгаляційний наркоз.
Хлоксил Сl3C – – CCl3 – лікування гельмінтозів печінки. Самостійна робота №5 Спирти. Феноли. Етери.
– багатоатомні спирти: класифікація, хімічні властивості та добування етиленгліколю, гліцерину; – етери: визначення, класифікація, загальна формула, фізичні та хімічні властивості, добування.
Багатоатомні спирти · Двохатомні спирти – гліколі: СН2 – ОН Загальна формула СnH2n (ОН)2 ׀ СН2 – ОНетиленгліколь
· Трьохатомні спирти – гліцерини: СН2 – ОН Загальна формула СnH2n–1 (ОН)3 ׀ СН – ОНгліцерин ׀ СН2 – ОН
· СН – ОН
СН2 – ОН Сиропоподібні рідини без кольору та запаху, солодкуваті на смак, розчинні у воді.
Етиленгліколь Хімічні властивості: 1 – взаємодія з активними металами: СН2 – ОН CH2 – ONa ׀ + 2Na → ׀ + H2↑ СН2 – ОН CH2 – ONa 2 – нітрування: СН2 – ОН CH2 – ONO2 ׀ + 2HNO3 → ׀ + 2H2O СН2 – ОН CH2 – ONO2 3 – взаємодія з галогеноводнями: СН2 – ОН CH2 – Cl
СН2 – ОН CH2 – OH 4 – якісна реакція:
СН2 – ОН CH2 – O синій колір
Добування – окислення етилену (реакція Вагнера): СН2 = СН2 + [O] + НОН → СН2 – СН2
ОН OH
Гліцерин Хімічні властивості: 1 – взаємодія з активними металами:
2 – нітрування:
CH – OH + 3HNO3 → CH – ONO2 + 3H2O
3 – взаємодія з галогеноводнями:
СН2 – ОН CH2 – OH
4 – якісна реакція:
СН2 – ОН CH2 – OH синій колір
Добування гліцерину: І етап – окислення пропілену (реакція Вагнера): СН3 – СН2 = СН2 + [O] + НОН → СН3 – СН – СН2 ׀ ׀ ОН OН
ІІ етап – галогенування: hυ СН3 – СН – СН2 + Cl2 → СН2 – СН – СН2 + HCl ׀ ׀ ׀ ׀ ׀ ОН OН Cl OH OH
ІІІ етап – лужний гідроліз: СН2 – СН – СН2 + КОН → СН2 – СН – СН2 + KCl ׀׀׀׀׀׀ Cl OH OH ОН OH OH
Етери (прості ефіри) · це органічні сполуки, в молекулах яких два вуглеводневих радикали зв’язані атомом Оксигену: R – O – R Якщо радикали однакові, то етер називають симетричним; якщо різні – несиметричним (змішаним): СН3 – О – СН3 диметиловий етер С2Н5 – О – С2Н5 діетиловий етер СН3 – О – С2Н5 етилметиловий етер Загальна формула СnH2n+2O Ізомерія: – за вуглецевим скелетом; – міжкласова ізомерія (зі спиртами).
Фізичні властивості: Нижчі етери – гази або легко леткі рідини з характерним запахом, легко займаються, у воді нерозчинні, але самі є хорошими органічними розчинниками. У суміші з повітрям вибуховонебезпечні.
Хімічні властивості: Хімічна активність етерів невелика, зв’язки С – О міцні й розриваються важко.
1 – розкладання етерів під дією йодоводню при нагріванні – йод з’єднується з меншим радикалом: СН3 – О – С2Н5 + НІ → СН3І + С2Н5ОН HCl та HBr не розкладають етери.
2 – розкладання етерів під дією концентрованої сульфатної кислоти: СН3 – О – С2Н5 + НО – SO3H → СН3 – O – SO3H + С2Н5ОН складний ефір – метилсульфатна кислота Добування: 1 – міжмолекулярна дегідратація спиртів
CH3OH до 140°С
C2H5OH до 140°С 2 – з алкоголяту та галагенопохідного C2H5 – ONa + I – CH3→ С2Н5 – О – СН3 + NaI
Використання у медицині: Діетиловий етер (сірчаний ефір) – інгаляційний наркоз. Самостійна робота №6 Альдегіди та кетони
– пропаналю; – бутанону.
Самостійна робота №7 Монокарбонові кислоти 1. Скласти рівняння реакцій, що підтверджують хімічні властивості: – пропіонової кислоти; – масляної кислоти; – валер’янової кислоти; – акролеїнової кислоти; – бензойної кислоти; – стеаринової кислоти; – олеїнової кислоти.
Самостійна робота №8 Дикарбонові кислоти 1. Скласти рівняння реакцій, що підтверджують хімічні властивості: – малонової кислоти; – янтарної кислоти; – малеїнової кислоти; – мета-фталевої кислоти.
2. Здійснити перетворення: етан → етилен → етанол → оцтова кислота → натрій ацетат → метан → → ацетилен → бензол → толуол → бензойна кислота → натрій бензоат
Самостійна робота №9 Самостійна робота №10 Естери. Жири. 1. Скласти конспект з питань: – естери: визначення, загальна формула, номенклатура, хімічні властивості, добування; – жири: визначення, класифікація, хімічні властивості, добування, біологічна роль; – воски: тваринні та рослинні; м’які та тверді. 2. Скласти рівняння добування з саліцилової кислоти: – метилсаліцилату; – фенілсаліцилату.
3. Здійснити перетворення: а) етан → етанол → оцтова кислота → метилацетат → етилацетат → калій ацетат → → ферум (ІІІ) ацетат
б) ацетилен → бензол → толуол → бензойна кислота → метилбензоат → натрій → → бензойна кислота → амід бензойної кислоти бензоат
Зміст теми: Естери · це похідні карбонових кислот, у яких група ОН заміщена залишком спирту.
Номенклатура
O – С2Н5 етиловий естер мурашиної кислоти
O – СН3 метиловий естер оцтової кислоти
Ізомерія: ·
O – СН3 О – С2Н5
· міжкласова
O – СН3 ОН
Хімічні властивості:
· О – С2Н5
· СН3 – С + NaОН → СН3СООNa + С2Н5ОН
·
·
Добування – реакція естерифікації:
О – С2Н5
Використання у медицині: метилсаліцилат, фенілсаліцилат (фармакологічну дію дивись в темі „Саліцилати”)
Жири · це естери спирту гліцерину та вищих жирних кислот. Класифікація жирів: · змішані · рідкі (олії) · рослинні Хімічні властивості: · гідроліз СН2 – О – СО – С15Н31 СН2 – ОН СН – О – СО – С15Н31 + 3НОН → СН – ОН + 3С15Н31СООН СН2 – О – СО – С15Н31 СН2 – ОН
· лужний гідроліз (омилення) СН2 – О – СО – С15Н31 СН2 – ОН СН – О – СО – С15Н31 + 3NaОН → СН – ОН + 3С15Н31СООNa СН2 – О – СО – С15Н31 СН2 – ОН мило
· гідрогенізація рідких жирів СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35 СН – О – СО – С17Н33 + 3Н2 → СН – О – СО – С17Н35 СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35
Добування жирів:
СН2 – ОН СН2 – О – СО – С15Н31 СН – ОН + 3С15Н31СООН → СН – О – СО – С15Н31 + 3Н2О СН2 – ОН СН2 – О – СО – С15Н31
Біологічна роль жирів:
· енергетична функція; · поживна функція; · захисна функція; · терморегуляція. Воски
· це естери вищіх карбонових кислот та вищіх спиртів.
Воски поділяють на тваринні (спермацет, бджолиний віск, ланолін) та рослинні (воски з листів рослин). Температура плавлення восків зростає зі зростанням карбонових радикалів кислот та спиртів. У зв'язку з цим воски бувають м’які та тверді.
М’які воски: · ланолін – виробляється шкірними залозами вівець. Використовують як основу лікарських мазей. · спермацет – добувають з голови кашалоту. Використовують як основу лікарських мазей. Тверді воски: · бджолиний віск – добувають з бджолиних сотів. Використовують як основу лікарських мазей та косметичних препаратів. Самостійна робота №11 Вуглеводи 1. Скласти конспект з питань: – класифікація дисахаридів; – сахароза: добування, гідроліз; – мальтоза: добування, окислення, гідроліз; – лактоза: добування, окислення, гідроліз; – крохмаль: будова, фотосинтез, властивості, біологічна роль; – целюлоза: будова, властивості, ефіри целюлози, біологічна роль; – використання вуглеводів у медицині.
Сахароза
· Добування: СН2ОН
+ + →
Н ОН ОН Н α – глюкоза β – фруктоза СН2ОН
+ Н2О
Н ОН сахароза ОН Н · Гідроліз: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 глюкоза фруктоза Мальтоза · Добування: СН2ОН СН2ОН
Н ОН Н ОН α – глюкоза α – глюкоза СН2ОН СН2ОН
Н ОН Н ОН мальтоза
· Реакція „срібного дзеркала”: СН2ОН СН2ОН
Н ОН Н ОН
СН2ОН СН2ОН
Н ОН Н ОН
· Гідроліз: С12Н22О11 + Н2О → 2С6Н12О6
Лактоза · Добування: СН2ОН СН2ОН
Н ОН Н ОН β – галактоза α – глюкоза СН2ОН СН2ОН
Н ОН Н ОН лактоза
· Реакція „срібного дзеркала”: СН2ОН СН2ОН
Н ОН Н ОН
СН2ОН СН2ОН
→
Н ОН Н ОН
· Гідроліз: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 галактоза глюкоза Крохмаль · Будова молекули: СН2ОН СН2ОН
Н ОН Н ОН Складається з залишків α – глюкози: – амілоза (25%) – лінійна форма; – амілопектин (75%) – розгалужена форма. • Фотосинтез: 6n CO2 + 5n H2O → (C6H10O5)n + 6n O2
· Властивості:
1 – в гарячій воді утворює колоїдний розчин (клейстер); 2 – якісна реакція – з йодом дає синє забарвлення; 3 – гідроліз (ферментативний або кислотний): (C6H1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 510; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.200.26 (0.012 с.) |



 А ׃ В → А · + · В
А ׃ В → А · + · В hυ
hυ
 Приклади: Cl ׃ Cl Cl · + · Cl
Приклади: Cl ׃ Cl Cl · + · Cl H ׃ C ׃ H + · Cl H ׃ C · + H:Cl
H ׃ C ׃ H + · Cl H ׃ C · + H:Cl А ׃ В → А+ +: В–
А ׃ В → А+ +: В– Приклади: Н ׃ Cl → Н+ +: Cl –
Приклади: Н ׃ Cl → Н+ +: Cl – Н ׃ ОН → Н+ +: ОН–
Н ׃ ОН → Н+ +: ОН– Циклопропан – інгаляційний наркоз.
Циклопропан – інгаляційний наркоз. пропанол – 1
пропанол – 1
 2 – нітропропан
2 – нітропропан бутанол – 2
бутанол – 2
 полі – 2 – бутен
полі – 2 – бутен



 πσ
πσ
 Знебарвлення бромної води та розчину KMnO4
Знебарвлення бромної води та розчину KMnO4

 Шестиатомні спирти: СН2 – ОН
Шестиатомні спирти: СН2 – ОН
 СН – ОН сорбіт
СН – ОН сорбіт СН – ОН
СН – ОН
 СН2 – ОН CH2 – O
СН2 – ОН CH2 – O ׀ + Cu(OH)2 → ׀ Cu + 2H2O
׀ + Cu(OH)2 → ׀ Cu + 2H2O

 2 CH – OH + 6Na → 2 CH – ONa + 3H2↑
2 CH – OH + 6Na → 2 CH – ONa + 3H2↑



 СН2 – ОН CH2 – O
СН2 – ОН CH2 – O

 CH3OH H2SO4
CH3OH H2SO4
 СН3 – О – СН3 + H2O
СН3 – О – СН3 + H2O CH3OH H2SO4
CH3OH H2SO4
 СН3 – О – С2Н5 + H2O
СН3 – О – С2Н5 + H2O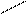 Загальна формула
Загальна формула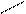


 O
O Н – C мурашино–етиловий естер або
Н – C мурашино–етиловий естер або
 O
O СН3 – C оцтово–метиловий естер або
СН3 – C оцтово–метиловий естер або

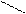

 О
О
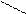


 за складом прості
за складом прості
 за фізичними властивостями тверді
за фізичними властивостями тверді
 за походженням тваринні
за походженням тваринні
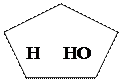
 О О
О О




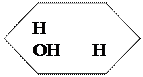 О О
О О






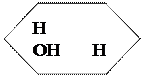










 глюкоза
глюкоза

 → О + Н2О
→ О + Н2О






