Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рахмедин рушангуль турганжановнаСодержание книги
Поиск на нашем сайте
РАХМЕДИН РУШАНГУЛЬ ТУРГАНЖАНОВНА ИССЛЕДОВАНИЯ, МЕТОДОЛГИЯ СИНТЕЗА НОВЫХ α- ОКСИФОСФОНАТОВ АРОМАТИЧЕСКОГО РЯДА В УСЛОВИЯХ РЕАКЦИИ АБРАМОВА ДИПЛОМНАЯ РАБОТА Специальность 5В011200 - «Химия» (Дневное отделение 4 года, 4 курс)
Алматы, 2016 г. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН КАЗАХСКИЙ ГОСУДАРСТВЕННЫЙ ЖЕНСКИЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ
Факультет Естествознания Кафедра Химии
«Допущена к защите» Заведующей кафедрой химии к.х.н., и.о. асоц. профессора ________ Мырзахметова Н.О. «» ______ 2016 г.
ДИПЛОМНАЯ РАБОТА На тему: «ИССЛЕДОВАНИЯ, МЕТОДОЛГИЯ СИНТЕЗА НОВЫХ α- ОКСИФОСФОНАТОВ АРОМАТИЧЕСКОГО РЯДА В УСЛОВИЯХ РЕАКЦИИ АБРАМОВА»
специальность 5В011200 - «Химия» (Дневное отделение 4 года, 4 курс)
Выполнила: Рахмедин Р.Т Научный руководитель Джиембаев Б.Ж. Д.х.н., профессор Алматы, 2016 г. РЕФЕРАТ
РЕФЕРАТ
THE ABSTRACT
СОДЕРЖАНИЕ ВВЕДЕНИЕ................................................................................................................................ I. ЛИТЕРАТУРНЫЙ ОБЗОР ………………………………………………………… 1.1. Общая характеристика карбонильных соединений 1.2. Особенности химических свойств альдегидов. Механизм реакции 1.2.1. Реакции присоединения по карбонильной группе Реакции присоединения-отщепления (реакции с азотистыми нуклеофилами). 1.2.3 Реакции с участием атомов водорода при a – углеродном атоме 1.2.4 Реакции окисления Оксибензойные альдегиды. Методы получения. Химические свойства и биологическая активность Методы получения альдегидов ванилинового ряда Синтез новых биологически активных соединений на основе оксиальдегидов ароматического ряда II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ ………………………………………………….. 2.1. Методы исследования ……………………………………………………………………. 2.2. Исходные реагенты ………………………………………………………………………. III. ОБСУЖДЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ РЕЗУЛЬТАТОВ ……………………… 3.1. ВЫВОД ………………………………………………………………………………………….. СПИСОК ИСПОЛЬЗОВАННЫХ ЛИТЕРАТУР ………………………………………..
НОРМАТИВНЫЕ ССЫЛКИ Нормативные ссылки использованные для диссертационной работы: Инструкция для подготовки автореферата и диссертации МОН РК Комитет аттестации и контроля в сфере образования и науки, Алматы, 2004, с23 ГОСТ 7.1 – 2003 Стандартная система информации по библиографии и типографии. Библиографический прочерк,схематизация и их правила и требования ГОСТ 7.32 – 2001 Стандартная система информации по библиографии и типографии. Отчет научной работы, Структура и правила оформления ГОСТ 8.417 – 81. Единая система государственой измерительной величины. Физические величины измерения. ГОСТ 7.1 – 84 Ссылка на литературы ГОСТ 7584-77 Лабораторная фильтровальная бумага ГОСТ 28498 – 90. Термометр ГОСТ 157-78 Реактивы. Ванилин ГОСТ 5955-75 Реактивы. Бензол. ГОСТ 16599-71 Ванилин. Технические условия ГОСТ 6709-72. Дистиллированная вода.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ, СИМВОЛОВ И ОБОЗНАЧЕНИЙ ИК инфракрасная спектроскопия ПМР протонно – магнитный резонанс ЯМР 13С ядерно – магнитный резонанс 13 углерода ЯМР 31Р ядерно – магнитный резонанс 31 фосфора ТСХ тонкослойная хромотогафия Ткип. Температура кипения Гц Герц г грамм см-1 обратный сантиметр М Моль мл миллилитр 0С градус Цельсия ст. усл. стандартные условия х.ч. химически чистый аром.СН ароматические углеводороды А.р. реакция Абрамова ДМФ диметилфосфит В ванилин СА сиреневый альдегид ГФС гидрофосфорильные соединения АА анисовый альдегид ВА вератровый альдегид РЕЗЮМЕ Дипломная работа содержит страниц, рисунков, таблиц, источников литературы. Ключевые слова: ароматическиеоксиальдегиды, ванилин, анисовый альдегид, вератровый альдегид, методы получения, химические модификации, оксифосфонаты, фосфорилирование, реакция Абрамова, ИК–спектроскопия, биологическая активность, применение. Актуальность исследования: поиск новых реакционноспособныхсинтонов для целенаправленного синтеза модифицированных производных ароматических альдегидов; разработка методов синтеза новых фосфороргани-ческих производных альдегидов ароматического ряда. Цель работы заключается в поиске новых путей модификации молекулярной структуры ароматических альдегидов путем введения активных полифункциональ-ных фармакофорных фрагментов и в установлении строения модифицированных производных. Объектом исследования в данной работе является природные альдегиды ароматического ряда, диалкилфосфиты. Методы исследования. В процессе исследования были использованыреакции фосфорилирования по карбонильной группе, также методы препаративной органической химии и тонкого органического синтеза. Выделение и очистка целевых продуктов проводилась методами перекристаллизации, перегонкой; идентификация синтезированных соединений – физико - химическими методами (ИК спектроскопии, элементного анализа). Полученные результаты. Исследованы реакции функционализации ароматических альдегидов по карбонильной группе. Состав и строение полученных соединений подтверждены данными элементного анализа и ИК спектроскопии и вторичными модификациями функциональных групп. Новизна данных исследований. Осуществлен синтез ряда новых потенциально биологически активных веществ на основе ванилина, вератрового и анисового альдегидов; изучены их химические, физико-химические свойства; установлено их строения с привлечением современных физико-химических методов. Качественная характеристика собранного фактического материала. Проведена оценка сведений о степени разработанности проблемы исследования и химическоймодификации молекулярной структуры ароматических альдегидов на основе проработки патентной и научной литературы. В результате исследованийразработаны методы синтеза новых биологически активных фосфорзамещенных производных альдегидов ароматического ряда. Введение Актуальность. На сегодняшний день химия гидрофосфорильных соединений (ГФС) накопила большой фактический материал, что отражено в опубликовании ряда обзоров и монографий. ГФС на современном этапе развития фосфорорганической химии служат объектами структурных и других важных теоретических исследований, популярными полупродуктами в синтетической химии, они широко изготавливаются и применяются в промышленности. С другой стороны методы химии ГФС стали использоваться и в области природных соединений (углеводы, нуклеиновые кислоты, липиды). Одной из фундаментальных проблем химии природных соединений является создание новых полифункциональных производных альдегидов, содержащие Р − С связь. Фосфорорганические соединения со Р − С - связью занимают заметное место в списках, производимых в промышленных масштабах химических средств защиты растений, лекарственных препаратов, экстрагентов, присадок к маслам и топливам, антипиренов и другой практически значимой продукции. Поэтому понятен постоянный интерес исследователей к развитию методов синтеза соединений со Р − С связью. С другой стороны, введение фосфорсодержащих фрагментов в молекулу альдегидов может привести к созданию биологически активных веществ различного действия, являющихся базой для получения биологически активных веществ, что составляет актуальную задачу. Целью работы является разработка синтеза новых фосфорилированных производных природных ароматических альдегидов путем введения фосфорсодержащих фрагментов в молекулы и установление их биологической активности, выявление среди полученных продуктов соединений с биологической активностью. Теоретическая значимость Развитие теоретических вопросов по синтезу новых функционально-замещенных производных природных альдегидов ароматического ряда. Новизна работы Научная новизна работы заключается в разработке синтеза новых, ранее неизученных производных природных альдегидов ванилинового ряда путем введения фосфорильного и сложноэфирного фрагментов. Практическая значимость Новые производные альдегидов представляют интерес как потенциальные, высокоактивные, малотоксичные субстракты при создании регуляторов роста растений и новых лекарственных средств. В работе использованы методы современного тонкого органического синтеза - реакция Абрамова. Для идентификации новых соединений физико-химические методы установления строения органических соединений (ИК- спектроскопия, элементный анализ). Ожидаемые результаты Новые фосфорсодержащие производные природных альдегидов и изучение их свойств
ЛИТЕРАТУРНЫЙ ОБЗОР Механизм реакции
Б. Реакции альдольной и кротоновой конденсации. Конденсация – это реакция, приводящая к усложнению углеводородного скелета. В альдольной и кротоновой конденсациях участвуют две молекулы карбонильного соединения. Одна молекула – карбонильная компонента, реагирует с помощью карбонильной группы, другая – метиленовая компонента за счет атомов водорода α − положения. а) Альдольная конденсация (реакция катализируется основаниями)
Механизм AdNu Альдоли способны при нагревании в щелочной среде отщеплять воду и превращаться в a,b – непредельные альдегиды (кетоны).
б) Кротоновая конденсация (в кислой среде при нагревании). Протекает по механизму АdE.
В кислой среде при нагревании конденсация не останавливается на стадии образования альдоля. Происходит внутримолекулярная дегидратация альдоля до непредельного альдегида или кетона. При участии в реакции пропаналя, бутаналя и других альдегидов получают альдегиды и кетоны, имеющие в положении С–2 алкильную группу.
Механизм AdЕ
1.2.4 Реакции окисления. Альдегиды окисляются в мягких условиях до карбоновых кислот, проявляя свойства восстановителей.
Реакции с растворами Толенса (реакция серебряного зеркала) и Фелинга используются при идентификации карбонильных соединений. В ароматических соединениях бензольное кольцо (1.3), находящееся в сопряжении с карбонильной группой, проявляет более сильное электронодонорное действие, чем алкильный радикал. За счет положительного мезамерного эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода [9 –11]: 1.3 1.4 Вследствие сказанного ароматические альдегиды менее реакционноспособны, чем алифатические (1.4). Карбонильная группа является сильным электроакцептором и всегда –I, –М эффект, оттягивает электронную плотность от арилаÞ мета -ориентант, дезактиватор. За счет слабого электронодонорного действия бензойного ядра связь С–Н формильной группе сильнее поляризована и химически активна:
Рис.3 Химические превращения ароматических альдегидов В молекулах альдегидов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) – газ, альдегиды С2–C5 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает [18]. Ароматические альдегиды являются высококипящими жидкостями или легкоплавкими твердыми веществами. Ароматическое ядро сильно уменьшает их растворимость в воде [8,9,20]. Все альдегиды имеют сильный запах. Для низших альдегидов характерен неприятный запах. Альдегиды содержащие, 8-12 атомов углерода (С8-12) являются душистыми веществами [20–22]. Парфюмерные композиции с альдегидами (бензальдегид, ваниль, анисовый и салициловый альдегиды, пропаналь, мирценаль, деканаль, додеканаль, нонаналь, цитраль,гидрок-сицитронеллаль, фенилальдегид) уже давно стали классикой в парфюмерии (Chanel №5-децеальдегид) [18]. Следует отметить, что наибольший объем мирового производства альдегидов (несколько млн. т/год) приходится на альдегиды С1–С4 [23]. Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, кислородсодержащих гетероциклов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей, пищевых ароматизаторов, как коррозионный ингибитор для стальных и железных сплавов (коричный альдегид) [24-26]. Альдегиды применяют для получения спиртов (бутилового, 2-этил-гексанола, пентаэритрита и др.), карбоновых кислот и их производных (уксусной, надуксусной, уксусного ангидрида, винилацетата), антиоксидантов, пиридиновых оснований [27–29]. Коричный альдегид используется как фунгицид. Его низкая токсичность и доказанная эффективность для более чем 40 различных зерновых культур делают его идеальным для сельского хозяйства. Кроме этого коричный альдегид применяется в качестве инсектицида и средства для отпугивания животных (кошек и собак) [26]. Некоторые альдегиды (формальдегид, паральдегид, цитраль) применяют в медицинской практике. Альдегиды обладают выраженным противовоспалительным действием, а также успокаивают центральную нервную систему. Одни из них снижают давление, другие понижают температуру при лихорадке. К ним относятся цитраль (содержится в лимоне, лимонной траве, цитронелле, герани и др.); цитронеллал (содержится в цитронелле, эвкалипте, лимоне, мелиссе и др.); фелландраль (содержится во многих эфирных маслах, экстрагированных из деревьев); анисовый альдегид (содержится в анисе, ванили и др.); коричный альдегид (в больших количествах содержится в коре коричного дерева и в небольших листьях) [30–32]. Физиологическое действие препаратов, имеющих в молекуле альдегидную группу, различно и зависит главным образом от характера алкильного остатка, связанного с карбонильным углеродом (табл. 1) [3,8,19–29,33–36].
Таблица 1 − Лекарственные препараты содержащие в молекуле альдегидную группу, и их основное действие в организме
Наличие альдегидной группы придает соединениям наркотические свойства, табл.1. Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность. Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля (1.5) более выражены, чем у ацетальдегида (1.6).
Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путем образования гидратной формы альдегида (1.7). Способность к образованию гидратной формы проявляется лишь у хлорированного альдегида. Так, гидратная форма хлораля мало токсична, в такой форме хлораль применяется в медицине под названием хлоралгидрата, проявляющего снотворное действие [32,34,35]. Альдегиды играют большую роль в биологических процессах, являясь промежуточными продуктами окисления аминов (образующихся декарбоксилированием аминокислот) до жирных кислот [37]. В ИК-спектрах альдегидов характеристические полосы поглощения v С=О лежат в области 1740-1720 см-1 (алифатические альдегиды), 1715-1695 см-1 (ароматические), 1705-1685 см-1 (непредельные); V C-H – в области 2880-2650 см-1. Химический сдвиг альдегидного протона в спектрах ЯМР (1Н) – в области 9,4-9,7 м.д. (алифатические альдегиды) и 9,6-10,1 м.д. (ароматические). Характерный дублет в спектрах ЯМР (13С), обусловленный группой 13СНО – в области 190-205 м.д. (на 5-10 м.д. в более сильном поле, чем сдвиги 13СО соответствующих кетонов). Электронные спектры содержат полосы с λ макс 290 нм для RCHO (R = CH3, C2H5, С3Н7), 345 нм для акролеина и 327 нм для кротонового альдегида (во всех случаях ∆λ ≈ 15-25); масс-спектры (RCHO)-пики, отвечающие ионам (НСО)+, (RCO)+ и R+. Если альдегиды имеют атомы Н в γ-положении, то для линейных соединений характерны пики при т/е 44, а для α-разветвленных - при т/е 44 + 12и, где п — 1, 2, 3... [38−40].
II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Методы исследования ИК спектры синтезированных соединений записывали на приборе…. в таблетках КBr. Температура плавления определена на приборе "Boetius". Контроль за ходом реакций осуществлен в тонком слое на оксиде алюминия в системе растворителей (бензол: ацетон в соотношении 2:1;10:1). Разделение и очистка продуктов реакции осуществлялась перекристаллизацией из чистых или смеси растворителей (гексан, петролейный эфир, ацетон, этиловый спирт). Индивидуальность синтезированных соединений определена с помощью тонкослойной хроматографии с использованием окиси алюминия второй степени активности и различных системах растворителей, проявитель – йод. Количественный и качественный состав полученного продукта исследованы элементным анализом. В процессе микроанализа использован метод определения P, C, H – сжигание в быстром токе кислорода. Рассчитан количественный состав P, C, H в (%). Исходные реагенты Ванилин – белое кристаллическое вещество
Систематическое наименование 4-гидрокси-3-метоксибензальдегид Химическая формула C8 H8 O3 Молярная масса 152,15 г/моль Плотность 1,056 г/см³ Температура плавления 80-81 °C Температура кипения 285 °C Растворимость (в г/100 г или характеристика): вода: в горячей – 1:20; легко растворим: этанол,эфир, хлороформ Анисовый альдегид
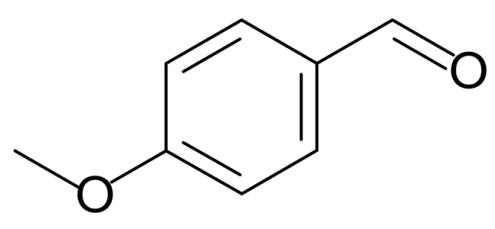
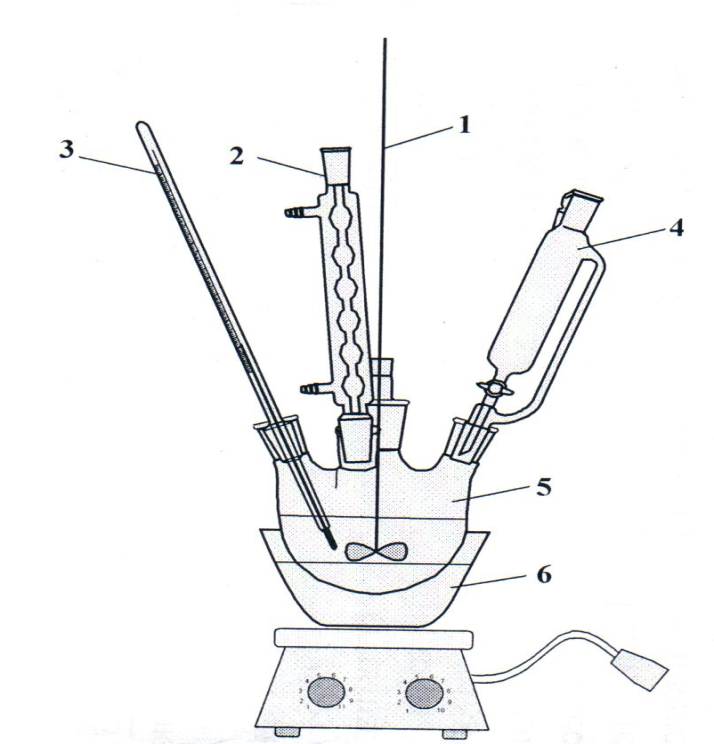
Систематическое наименование 4 – метоксибензальдегид Традиционные названия Анисовый альдегид Химическая формула C8H8O2 Эмпирическая формула n-СН3ОС6Н4СНО Физические свойства Состояние (ст. усл.) бесцветная или слегка желтовая жидкость Молярная масса 136,15 г/моль Плотность 1,119 (15 °C) г/см³ Динамическая вязкость (ст. усл.) 44,2 Па·с (при 20 °C) Термические свойства Температура кипения 248—249 °C (1013 гПа) Температура вспышки 108 °C Оптические свойства Показатель преломления 1,570—1,571 Классификация Рег. номер CAS 123–11–5 Растворим в этаноле и органических растворителях; плохорастворим в воде; Вератровый альдегид Систематическое наименование: 3,4 – диметоксибензальдегид Синонимы: ванилин метиловый эфир вератровый альдегид протокатеховый альдегид диметиловый эфир Внешний вид: бесцветные игольчатые кристаллы (растворитель перекристаллизации- диэтиловый эфир) Молекулярная масса (в а.е.м.): 166,18 Температура плавления (в °C): 45 Температура кипения (в °C): 281 Растворимость (в г/100 г: вода: не растворим; диэтиловый эфир: легко растворим; этанол: легко растворим Диметилфосфит Систематическое наименование:диметиловый эфир фосфористой кислоты Молекулярная масса 110. Химическая формула: (СН 3О) 2 РОН Существует в виде двух таутомеров (равновесие сдвинуто влево): (СН 3О)2Р(О)Н «(СН 3О) 2РОН. Диметилфосфит – бесцветная жидкость (из – за присутствия примесей обладает обычно неприятным запахом); т. кип. 56-58 °С/10 мм рт. ст.; d420 1,1944; nD20 1,4036; хорошо раств. в органических растворителях и воде. В спектре ЯМР 31Р хим. сдвиг относительно 85%-ной Н3РО4 составляет 11 м. д., константа спин-спинового взаимод. ядер Р и Н − 695 гц; полоса поглощения в ИК спектре для связи Р—Н – 2427 см–1. При хранении диметилфосфит медленно разлагается. При 250 °С превращается в пирофосфонат. Диэтилфосфит Формула: (С2Н 5О) 2 РОН Синонимы: (диэтиловый эфир фосфористой кислоты), Внешний вид: жидкость Растворимость (в г/100 г или характеристика): вода: растворим органические растворители: растворим Плотность: 1,0756 (20°C, г/см3) Показатель преломления (для D–линии натрия): 1,4081 (20°C) Давление паров (в мм.рт.ст.): 10 (71°C) Применение: В синтезе пестицидов, антипиренов. Компонент смазочных материалов, растворитель красок. Антиоксидант. 2.3.3 Взаимодействие альдегидофенолов с диалкилфосфористыми кислотами Исследование реакции взаимодействия анисового альдегида (2.) с диалкилфосфитами проводили в зависимости от следующих факторов:(таблица.3) - температуры реакции (до 30–35оС) с добавлением каталитического количества катализатора (алкоголята натрия); - температуры реакции (от 60–70оС) без добавления катализатора; - влияния природы растворителя (в среде петролейного эфира, бензола, диоксана). Лабораторное оборудование для проведения синтеза, показано на рисунке 1.
Рис.1– Лабораторное оборудование для проведения синтеза
1 – мешалка, 2 – обратный холодильник, 3 – термометр, 4 – капельная воронка, 5 – четырехгорлая колба, 6 – масляная баня. 2.3.4 Соединение (2.4 ). К смеси 5 г (0,05 моль) анисового альдегида (2.1) в 50 мл бензола (40–70 ºС) и 5,5 г (0,05 моль) диметилфосфита (2.2) по каплям при охлаждении и перемешивании прибавляют свежеприготовленный раствор метилата натрия в метиловом спирте с такой скоростью, чтобы температура реакционной смеси не поднималась выше 35ºС. Реакционную смесь перемешивают в течение 1-1,5 часов. Растворитель отгоняют под вакуумом водоструйного насоса. Остаток промывают спиртом и петролейным эфиром. Получают 4,45 г (66%) (2.4), прозрачное слегка желтоватого цвета масло, Rf 0,70. ИК - спектр, см-1: 1230 (Р=О), 1256 (С-О-С), 1045 (Р-О-С), 3290 (ОН), 1500-1590 (аром.СН). 2.3.5 Соединение ( 2.5 ). Получено аналогично (2.5) из (2.1). Выход 79,1%.Т.пл. 117-118 оС (гексан) и Rf 0,79 (бензол: ацетон, 10:3). ИК – спектр, см-1: 1220 (Р=О), 1260 (С–О–С), 1050 (Р–О–С), 3310 (ОН), 1500 – 1590 (аром.СН)).
2.3.7. Соединение (2.9) К смеси 5 г (0,05 моль) ванилина (2.8) в 50 мл бензола при комнатной температуре и 5,5 г (0,05 моль) диметилфосфита (2.2) по каплям при охлаждении и перемешивании прибавляют свежеприготовленный раствор метилата натрия в метаноле с такой скоростью, чтобы температура реакционной смеси не поднималась выше 35ºС. Реакционную смесь перемешивают в течение 1,5 – 2,0 час. Растворитель отгоняют под вакуумом водоструйного насоса. Остаток промывают спиртом и петролейным эфиром. Выход (2.9) 42,0% (П.Э). Продукт представляет собой мелкокристаллическое вещество сиреневатого цвета, Rf 0,89. ИК - спектр, см-1: 1230 (Р=О), 1220 (С−О−С), 1070, 1020 (Р−О−С), 3100 − 3200 (ОН), 1500-1590 (аром.СН).
2.3.8 Соединение (2.10) Получено аналогично (2.10) из (2.9). Выход 59,4%, т.пл. 65–67ºС, Rf 0,83 (бензол: ацетон, 10:3). ИК – спектр, см-1: 1245 (Р=О), 1220 (С–О–С), 1045, 1020 (Р–О–С), 3278 (ОН), 1500-1590 (аром.СН). И вератрового альдегида
Введение в молекулу ваниллоидов (4–гидрокси–3–метоксибензальдегид и его метилового эфира) фосфорильного фрагментов, характеризующихся высокой реакционной способностью, значительно расширяет исследовательские работы по синтезу полифункциональных соединений [ ]. Как отмечалось в литературном обзоре рассмотренные синтезы на базе ваниллоидов подтверждают перспективность использования данного класса соединений при поиске и создании новых биологически активных веществ. К сожалению, химические свойства ваниллоидов изучены в меньшей степени, чем методы их получения [ ]. В связи с чем нами проведены исследования изучению реакционной способности альдегидов (2.8,2.9) в условиях реакции Абрамова.
Реакцию ванилина (2.7) с диметилфосфитом (2.2) проводили в среде бензола при перемешивании эквимолярных количеств реагентов при комнатной температуре в течение 3 – 4 часов с добавлением каталитического количества насыщенного раствора алкоголята натрия. Добавление щелочного катализатора сопровождается увеличением температуры реакционной среды от 25 до 32ºС. Состав и строение полученного a – оксифосфоната (2.9) подтверждены данными элементного анализа, ИК спектроскопии, индивидуальность - тонкослойной хроматографией в различных системах растворителей. В ИК спектре соединения (2.9) отсутствует полоса поглощения карбонильной группы и проявляются интенсивные полосы поглощения, обусловленные валентными колебаниями Н-O (3272-3550 см-1) и Р=О и Р – О – С групп (1220, 1078-1028 см-1), а также наблюдаются полосы поглощения в области 700-932 см-1 (СН=СН) замещенного ароматического ядра. На основании данных ИК спектров нами установлено, что реакция фосфонилирования идет только по карбонильному фрагменту, не затрагивая гидроксильную группу. ТСХ на окиси алюминия показало индивидуальность выделенных эфиров. Следовательно, нуклеофильное присоединение диалкилфосфитов к карбонильной группе соединения (2.8) в присутствии катализатора приводит к образованию a – оксифосфонатов (2.9). Некоторые физико-химические характеристики синтезированных соединений представлены в таблице 3. В продолжение исследований в данном направлении и синтеза новых представителей оксифосфонатов, проведена реакция конденсации 3,4–диметоксибензальдегида (вератрового альдегида) с диметилфосфитом. Реакция конденсации альдегида (2.9) с диметилфосфитом (2.3) проводилась в среде бензола. При перемешивании реакционной смеси в течение 2 часов, при температуре 20–25°С с добавлением каталитических количества метилата натрия был выделен и охарактеризован α-оксифосфонат (2.12) с выходом 42%. Индивидуальность целевого продукта (2.9) контролировалось хроматографированием в тонком слое оксида алюминия (ацетон: бензол 2:1). Для подтверждения предполагаемого пространственного строения (2.12) и был снят его ИК спектр. Сравнительный анализ ИК спектров исходного альдегида (2.7) и целевого продукта (2.9) показал, что в спектре (2.9) отсутствует полоса поглощения карбонильной группы и проявляются интенсивные полосы поглощения, обусловленные валентными колебаниями О–Н – (3207-3290 см-1) и Р=О (1182-1223) и Р–О–С-связей (1097см-1). Валентным колебаниям С=С связи ароматических колец фенильных заместителей отнесены полосы поглощения при 1601-1585 см-1 и деформационные колебания в области замещенного ароматического кольца 755-995 см-1 .
Заключение Среди органических соединений фосфора большую группу составляют диалкилфосфористые кислоты (диалкилфосфиты), которые благодаря высокой реакционной способности и простоте их получения, являются важнейшими исходными веществами для синтеза различных фосфорорганических соединений. Интенсивное развитие химии фосфорорганических соединений внесло много нового в химию диалкилфосфористых кислот и их аналогов. Были открыты новые реакции диалкилфосфитов (например, реакции присоединения к кратным углерод – углеродным, углерод – кислородным, углерод-азотным, азот-азотным, азо – кислородным и т.д. связям), улучшены старые и предложены новые способы получения диалкилфосфитов и разработаны промышленные методы синтеза этих соединений. Одним из интересных классов фосфорорганических соединений, получаемых на основе диалкилфосфористых кислот, являются эфиры α–оксифосфоновых кислот. Этот класс соединений весьма интересен с точки зрения химических и физиологических свойств. В частности, среди таких эфиров и их производных найдены эффективные инсектициды, фунгициды и лекарственные препараты, рост стимулирующие препараты стабилизаторы полимеров. Предложенный B.C. Абрамовым, и в дальнейшем разработанный новый метод получения α–оксиалкилфосфоновых кислот, сделал их доступными соединениями, и в настоящее время он широко используется в химии фосфорорганических соединений. На большом экспериментальном материале было показано, что присоединение диалкилфосфористых кислот и других типов неполных эфиров кислот фосфора является характерной реакцией для альдегидов. Реакция является общий для окисей фосфинов и эфиров кислот фосфора, содержащих группу Р(О)Н. Подавляющее большинство методов получения соединений с Р–С -связью основано на взаимодействии эфиров кислот пяти– и трехвалентного фосфора с электрофильными реагентами. Однако высокая реакционная способность альдегидной группы по отношению к эфирам РIII затрудняет непосредственное введение к атому фосфора формил–содержащего радикала. Поэтому введение альдегидной групп или ее регенерация из производных должны осуществляться после образования Р–С -связи. При этом свойства характерные для альдегидной группы сохраняются, что в будущем будут более широко использованы потенциальные возможности альдегидной группы в фосфорорганическом синтезе. Химические свойства фосфорилированных изучены в значительно меньшей степени, чем методы их получения. Ограниченное число работ в этом направлении не позволяет пока дать широкие обобщения по изучению реакционной способности данного класса соединений. Со времени открытия реакций нуклеофильного присоединения диалкилфосфористых кислот к соединениям содержащим С=О, ON, С=С кратные связи прошло более 50 лет. Однако интерес к данному типу реакций не ослабевает, поскольку синтезируемые при этом продукты могут быть получены в промышленных условиях, а также являются интересными объектами для дальнейших биологических исследований. В настоящее время для Республики Казахстан особенно актуально развитие исследований в области создания новых высокоэффективных отечественных препаратов для нужд медицины и сельского хозяйства. Важнейшим этапом успешного решения этой проблемы является разработка современных методов тонкого органического синтеза новых веществ с потенциальной биологической активностью. Именно такие работы лежат в основе создания базы данных направленного поиска нового поколения веществ с заданными практически полезными свойствами, обеспечивающими научно-технический прогресс. С учетом интенсивного и успешного развития химии фосфорорганических соединений, представляется перспективным создание на новых α–оксифосфонатов на основе оксибензальдегидов. Выбор конкретного метода для препаративных целей определяются структурой альдегида и доступностью исходных соединений. Следует отметить, что в ряду ароматических оксиальдегидов, по ряду объективных причин, практически неизученными остаются возможности их использования в реакции Абрамова. В результате исследований получены новые экспериментальные данные по методам синтеза, установлению строения модифицированных фосфорилированных производных оксиальдегидов ароматического ряда:
Проведена наработка исходных соединений (диэтилфосфита, вератрового альдегида) по известным методикам. Физико – химические характеристики полученных веществ соответствуют литературным данным. Осуществлен синтез новых α-оксифосфонатов ароматического ряда на основе анисового, вератрового альдегидов, ванилина и диметил- и диэтилфосфитов. Состав и строение полученных соединений подтверждены данными элементного анализа и ИК–спектроскопии, индивидуальность – ТСХ на окиси алюминия в различных системах растворителей. РАХМЕДИН РУШАНГУЛЬ ТУРГАНЖАНОВНА ИССЛЕДОВАНИЯ, МЕТОДОЛГИЯ СИНТЕЗА НОВЫХ α- ОКСИФОСФОНАТОВ АРОМАТИЧЕСКОГО РЯДА В УСЛОВИЯХ РЕАКЦИИ АБРАМОВА ДИПЛОМНАЯ РАБОТА
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 808; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.70.108 (0.011 с.) |

 Галоформному расщеплению подвергаются ацетальдегид и метилалкилкетоны, при этом кроме галоформа в реакции образуются натриевые соли карбоновых кислот.
Галоформному расщеплению подвергаются ацетальдегид и метилалкилкетоны, при этом кроме галоформа в реакции образуются натриевые соли карбоновых кислот.