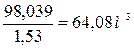Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энерго- и ресурсосбережение в переработке топливСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При расчете площади поверхности теплообмена в установках для нагрева жидкого топлива пользуются среднелогарифмической разностью температур, которая вычисляется по формуле:
где Δtср - среднелогарифмическая разность температур, К; Δt1 —разность температур теплоносителя (на входе) и нагреваемого вещества (на выходе); Δt2 — разность температур теплоносителя (на выходе) и нагреваемого вещества (на входе). Относительное движение теплоносителя и нагреваемого вещества рассматривается здесь и далее только противоточное, ибо это наиболее распространенный случай в процессах химической переработки топлива. Аналогично рассчитывается движущая сила адсорбции при улавливании продуктов химической переработки топлив. В промышленности данные материального баланса процессов химической переработки топлив принято приводить в массовых долях, а состав образующейся при этом газовой фазы в объемных долях. Для того чтобы эти данные были сопоставимы, надо сначала найти среднюю молярную массу, газа (по аддитивности, с учетом доли каждого компонента), затем условное число молей газовой смеси. М=∑ωi* Мi где М— молярная масса газа, выраженная в кг/кмоль; ωi - массовая доля компонента в газе, выраженная в долях единицы; Мi - молярная масса компонента, выраженная в кг/кмоль.
где п — условное число молей; т — масса вещества, из которого получается газ, кг; ω— массовая доля газа, выраженная в долях единицы; М — средняя молярная масса газа (выраженная в кг/кмоль).
Природный и попутный нефтяной газы широко используются как топливо. Для расчетов в этом случае пользуются правилом аддитивности: qн = ωi*qi где ωi — массовая или объемная доля газа от исходного сырья, выраженная в долях единицы; qi — удельная или объемная теплота сгорания компонента газа, выраженная в кДж/кг или кДж/м3. Зная теплоту сгорания топлива, можно рассчитать нужную его массу или объем для обеспечения того или иного процесса по формуле:
где т — масса или объем топлива, кг или м3; q — необходимое количество теплоты для обеспечения процесса, кДж; η — коэффициент полезного действия установки, в долях от единицы; qi — удельная или объемная теплота сгорания топлива, кДж/кг или кДж/м3.
Пример 1. Определите среднелогарифмическую разность температур для второй ступени АВТ, где нефть нагревается от 380 К до 630 К дымовыми газами, имеющими на входе температуру 1200 К, а на выходе 620 К. Решение.
Пример 2. При каталитическом крекинге керосина массовая доля газа равна 18 % от сырья. Определите массу метана, которая получится из 1 т керосина, если объемные доли компонентов газа крекинга: H2=9; CH4=27; C2H6=12 C3H8=3,5; C2H4=25; C3H6=15; C4H8=8,5%. Решение. Среднюю молярную массу смеси определяют по формуле: М =0,09*2+0,27*16+0,12*30+0,035*44+0,25*28+0,15*42+0,085*56 =27,7кг/кмоль Условное число молей смеси:
Масса метана в смеси: m(СН4)=6,5 кмоль*16 кг/кмоль*0,27 = 28,08 (кг). Элементы расчетов реакторов Пример 1. Производительность реактора дегидрирования н -бутана до н -бутенов составляет 17400 кг целевого продукта в час. Процесс проводят при 600 °С, и в этих условиях степень конверсии н -бутана равна 30%, а селективность по н -бутенам составляет 75%. Определить вместимость реактора, приняв для расчета константы скорости формулу: lg k' Решение.Уравнение реакции: СН3 — СН2 — СН2 — СН3 ↔ СН2 = СН — СН2 — СН3 + Н2 58 кг (22,4 м3) 56 кг 2 кг Расход н -бутана для проведения процесса:
теоретический фактический или 30933: 3600 = 8,6 м3/с. Константа скорости: lg k'= k'=1,2057 k = 0,1614 с-1 Предполагая, что дегидрирование н -бутана протекает по уравнению первого порядка, определим время пребывания реагирующих газов в зоне контакта: τ = Вместимость реактора: Vр=8,6*2,2= 19 м3 Пример 2. Время пребывания углеводородов при получении ацетилена электрокрекингом равно 0,001 с, объемный расход газов пиролиза равен 25500 м3/ч, скорость газов в реакционной камере составляет 900 м/с. Определить площадь сечения, высоту и объем реакционной камеры электродугового реактора. Решение. Секундная объемная производительность реактора (по газам электрокрекинга): N = 25 500: 3600 = 7,08 м3/с Объем реакционной камеры: Vр= Ncτ 7,08 • 0,001 =0,0071 м3 Площадь сечения реакционной камеры: S = Nc/ω = 7,08: 900 = 0,0079 м2 Высота реакционной камеры: H = Пример 3. Объемная скорость подачи этилена в реактор прямой гидратации равна 1900 ч-1, а объемный расход этилена составляет 22000 м3/ч. Определить объем катализатора, необходимый для проведения процесса. Решение. Объем катализатора: 22000: 1900 = 11,6 м 3 Пример 4. Производительность реактора окисления метанола составляет 3500 кг формалина в час; массовая доля формальдегида в нем равна 37%. Диаметр сечения аппарата 1,4 м, высота слоя контактной массы 75 мм. Определить производительность 1 кг и 1 л контактной массы. Насыпная плотность катализатора равна 600кг/м3. Решение.Производительность реактора по целевому продукту — формальдегиду: 3500 • 0,37 = 1295 кг/ч Объем катализатора в реакторе (V=πD2H/4=0,785D2H): 0,785 (1,4)2 * 0,075=0,115 м3 или 115 л Производительность 1 л катализатора: 1295: 115 = 11,3 кг/(л . ч) Масса катализатора в реакторе: 0,115 • 600 = 69 кг Производительность 1 кг катализатора: 1295: 69= 18,8 кг/(кг . ч)
Переработка нефти Пример 1. Определить компонентный состав бензиновой фракции (пределы выкипания 93—123 °С), полученной в процессе прямой гонки нефти, если количество получаемой фракции составляет 34800 кг/ч. Состав бензиновой фракции в массовых долях следующий: парафиновые углеводороды 27,2%, непредельные углеводород 0,7%, ароматические углеводороды 0,9%, нафтеновые углеводород 71,2%. Определить массовый расход нефти, необходимой для получения указанной фракции, если выход фракции составляет 20% общей массы нефти, затраченной на прямую гонку.
Решение.Массовый расход нефти для получения бензиновой фракции с учетом 20%-ного выхода:
Компонентный состав бензиновой фракции: Парафины Непредельные Ароматические Нафтены
Пример 2. Определить компонентный состав бензиновой фракции (52 800 кг/ч, пределы выкипания 58—93 °С), полученной пиролизом нефтяного сырья, если ее состав в массовых долях следующий: парафиновые углеводороды 4,9%, непредельные углеводороды 37,9%, ароматические углеводороды 56,2%, нафтеновые углеводороды 1%. Определить массовый расход нефти, необходимой для получения указанной фракции,, если выход фракции составляет 60 от общей массы нефти, затраченной на пиролиз. Условно принять молекулярную массу для нефти 282, для бензиновой фракции 14.
Решение.Массовый расход нефти для получения бензинов фракции:
Массовый расход нефти с учетом 60%-ного выхода:
Компонентный состав бензиновой фракции:
Парафины Непредельные Ароматические Нафтены Пример 3. Производительность установки платформинга по жидкому сырью составляет 1760 т/сут. Объемный расход смеси паров и циркуляционного водорода равен 2,57 м3/с в условиях процесса. Объемная скорость жидкого сырья, имеющего плотность 748 кг/м3, составляет 1,53 ч-1; линейная скорость паро-газовой смеси в сечении реактора равна 0,39 м/с. Определить общий объем катализатора в реакторах.
Решение.Объемный расход жидкого сырья на установке платформинга:
Объем катализатора в реакторах:
III. ПРИМЕРНЫЕ ЗАДАЧИ 1. Производительность реактора окислительного пиролиза метана равна 45 000 м3 газов пиролиза в час при времени реакции 0,003 с. Определить диаметр реакционной зоны, если ее длина составляет 600 мм. 2. Производительность реактора одностадийного дегидрирования н -бутана составляет 72 т бутадиена в сутки. Определить объем катализатора в реакторе, если производительность катализатора по бутадиену равна 90 кг/(м3. ч) 3. Массовый расход этилбензола в реакторе получения стирола равен 12,9 т/ч, а объемная скорость подачи жидкого этилбензола равна 0,5 ч-1. Плотность бензола равна 867 кг/м3. Определить высоту слоя катализатора в реакторе диаметром 6,5 м. 4. Массовый расход н -пентана в реакторе изомеризации равен 8,25 т/ч; плотность жидкого н -пентана равна 626 кг/м3. Определить объемную скорость подачи углеводорода в реактор, если объем катализатора составляет 12 м3. 5. Объемный расход метана, подаваемого в реактор газофазного хлорирования, равен 400 м3/ч; мольное отношение подаваемых метана и хлора равно 5: 1, а объемная скорость подачи газов в реакционное пространство составляет 240 ч-1. Определить рабочий объем реактора. 6. Производительность установки гидрохлорирования ацетилена равна 1,2 т винилхлорида в час при производительности катализатора по винилхлорид 50 кг/(м3. ч). Определить число реакторов, необходимых для обеспечения заданной производительности, если объем катализатора в каждом реакторе равен 6 м3. 7. Объемный расход синтез-газа в реакторе получения метанола равен 600 тыс. м3/ч, а объемная скорость подачи сырья составляет 10 000 ч-1. Определить производительность катализатора, если производительность реактора равна 12 т метанола в час. 8. В результате прямой перегонки нефти получено 9. В результате прямой перегонки нефти получено 10. В результате пиролиза нефти получено, в час 71 000 кг бензиновой фракции (93—123 °С), массовые доли компонентов в которой равны: парафины 7,1 %, непредельные 43%, ароматические 48,2%, нафтены 1,7%. Определить компонентный состав фракции и массовый расход нефти, если выход фракции составляет 68% от общего расхода нефти, поступающей на установку пиролиза. 11. В результате пиролиза нефти получено в час 68 000 кг бензиновой фракции (123—153 °С), массовые доли компонентов в которой равны: парафины 10,2%, непредельные 47,3%, ароматические 40,3%, нафтены 2,2%. Определить компонентный состав фракции и массовый расход нефти, если выход фракции составляет 70% от общего расхода нефти, поступающей на установку пиролиза. 12. При коксовании нефтяных остатков образуются нефтепродукты следующего состава (в массовых долях): 28% нефтяного кокса, 60% жидких дистиллятов, 12% крекинг-газа Рассчитать компонентный состав указанных продуктов, если на установку подают 38 800 кг нефтяного остатка в час, а степень его конверсии составляет 90%. 13. Вычислите теоретические расходные коэффициенты для получения сульфатным методом 1 т 30%-ной соляной кислоты. 14. Определите расходный коэффициент технического ацетальдегида (99%-ной чистоты) для получения 1 т уксусной кислоты: СН3СНО + 0,5О2→СН3СООН, если выход кислоты по альдегиду 93,5%. 15. Определите расходные коэффициенты сырья для производства 1 т фосфата аммония (NH4)3PO4, если исходные продукты: 55%-ная фосфорная кислота; 98%-ный аммиак, влаги — 2%. 16. Вычислите расходные коэффициенты на 1 т оксида серы (IV), если содержание серы в руде серного колчедана 45%, влаги—1,5%, воздух на обжиг колчеданаподают с избытком в 1,5 раза. 17. Для получения 1 т метилового спирта израсходовано 12065 м3 синтез-газа (СО: Н2= 1: 2). Рассчитайте выход метилового спирта при конверсии, если превращение за проход исходной смеси газов — 20%. Суммарная реакция получения дивинила по способу С. В, Лебедева выражается уравнением 2С2Н5ОН→СН2 = СН — СН = СН2 + 2Н2О + Н2 Выход дивинила составляет 80%. Вычислите, сколько кг дивинила можно получить из 2000 м3 96%-ного спирта (ρ = 80,0 кг/м3). 18. Составьте материальный баланс процесса упаривания 100 т раствора NaOH, если первоначальная концентрация его была 15%-ной, а упаренного раствора 60%-ной. Потери при упаривании составляют 0,3%. 19. Составьте материальный баланс на получение 1 т карбида кальция, содержащего 90% СаС2, сырье —антрацит марки АК с содержанием 96% углерода, а известь — 85% СаО. 20. Составьте материальный баланс производства 1000 м3 аммиака, если азотно-водородная смесь получается смешением сырого азота (N2 — 99,6%, О2 — 0,2%, Аг —0,2%) и сырого водорода (Н2 —99,6%, СН4 —0,2%, СО—0,2%). Синтез ведут под давлением 30,3 . 106 Па, при температуре 673К. Концентрация аммиака в газах после колонны синтеза 18%, а в циркуляционном газе 4%, содержание других газов в циркуляционном газе 3%. 21. Составьте материальный баланс производства 1 т чистого метилового спирта, если исходная смесь газов состоит только из СО и Н2 в соотношении 1: 2, конверсия синтез — газа 20%. Выход метилового спирта составляет 87% от теоретического. 22. Составьте упрощенный материальный баланс на получение 1 т уксусной кислоты (без учета побочных реакций), если выход кислоты по реакции СН3СНО + 0,5 О2→СН3СООН составляет 96% (от теоретического), технический ацетальдегид 99%-ной чистоты и реагирует на 98%, кислород связывается на 99%, иепрореагировавшего ацетальдегида остается 2%, кислорода 1% (2% ацетальдегида расходуется на побочные реакции).
23. Определите энтальпию и тепловой эффект реакции газификации твердого топлива, если из генератора водяного газа выходит газ следующего состава (в % по объему): СО —38, Н2 —50; С02 —6,2; N2 —5,8. Расчет следует вести на 1000 м3 генераторного газа. Теплота образования (в кДж/моль): СО— 110,580; Н2О (пар) —242,0; СО2 —343,79. 24. Определите теплоту образования ацетилена, если известно, что при сгорании 1 моль его выделяет 1608,1 кДж теплоты, а теплоты образования воды и углекислого газа составляют соответственно 241,840 кДж/моль и 394,08 кДж/моль. 25. Составьте тепловой баланс реактора синтеза метанола, если исходный газ имеет состав (в % по объему): 20 СО и 80 Н2, скорость его подачи 80000 м3/ч при температуре на входе в реактор 473К, а на выходе 573 К. Конверсия СО 35%. Теплоемкость газа на входе и на выходе одинакова и равна 32,3 (кДж/моль*К). С помощью холодильника отводится 20 240 000 кДж. 26. В 1975—1977 гг. в мире производили ежегодно 30 млн. т водорода. При этом около 70% получали из природного газа. Если известно, что за данный период добывали 700 млрд. м3 природного газа, рассчитайте, какая массовая доля его шла на производство водорода. Реальный выход водорода при паровой конверсии метана 2,3 моль/моль СН4. Необходимо принять во внимание, что объемная доля метана в природном газе равна 90%. 27. Возможно получение метана из бурого угля с использованием теплоты ядерного реактора. Переработка такого угля массой 660 т с массовой долей углерода в угле 55,6% дает метан объемом 1,1*105 м3. Определите выход метана в процентах от теоретического. 28. Один ядерный реактор мощностью 3000 кВт может обеспечить работу семи газогенераторов с массовым расходом 40 т/ч буроугольного полукокса с массовой долей углерода 72%. При этом получается синтез-газ для производства метанола, объемная доля СО в котором 31,5, а водорода 66,3%. Приняв выход метанола 80% от теоретического, а степень превращения полукокса в газ 90%, рассчитайте массу метанола, которую можно получить на установке за сутки. 29. Рассчитайте, какой объем аммиака в год может быть получен при совместной работе коксохимического завода, перерабатывающего в год шихту массой 6 млн. т, и кислородно-конверторного цеха, где в сутки подвергают разделению 1,88*106 м3 воздуха. Принять выход газа от шихты 300 м3/т. Объемная доля водорода в газе равна 55%, объемная доля азота в воздухе 78%. 30. При полукоксовании торфа получается газ, в котором объемные доли компонентов равны: Н2—16; СН4—18; СО2—41; азот—11,5; СО—13,5%. Выход газа 18% от массы исходного сырья. Рассчитайте, какую массу торфа следует подвергнуть полукоксованию для заполнения газом газгольдера диаметром 18 м и высотой 6 м (н. у.). 31. Энерготехнологический комбинат, где в год 32. Рассчитайте теплоту, которую нужно отвести с помощью холодильника из реактора синтеза метанола, если тепловой эффект реакции Qρ=90 085 кДж/моль; исходный синтез-газ имеет состав 20% СО и 80% Н2 (по объему), скорость подачи его 80 000 м3/ч при температуре на входе в реактор 473К, а на выходе 573 К. Конверсия СО 35%. Теплоемкость газа на входе и на выходе одинакова и равна Сρ= 32,3 кДж/(кмоль*град). Тепловыми потерями пренебречь. 33. Синтез метилового спирта ведут под давлением 3 . 107 Па и при температуре 623—673 К. Выходящий из реактора газ имеет состав (в % по объему): СН3ОН—16, СО—12, Н2—72. Рассчитайте соотношение СО и Н2 в исходном газе, поступающем в колонну синтеза. 34. Состав газа (в % по объему), образующегося при электрокрекинге метана: С2Н2—13,3; С2Н4—0,9; СН4—27,5; Н2—48,4, других ацетиленовых углеводородов и бензола 9,9%. Из газа выделяют ацетилен абсорбцией диметилформамидом. При этом происходит отделение этилена и других органических примесей. Отходящие газы содержат в основном водород и метан. Вычислите: 1) состав газа после обработки диметилформамидом; 2) сколько аммиака (теоретически) можно получить из 1000 м3 газа электрокрекинга метана? 35. При окислительном пиролизе природного газа с целью получения ацетилена необходимая теплота получается за счет сжигания части метана. Подсчитайте общий тепловой эффект реакций термоокислительного крекинга (пиролиза) метана, если основные реакции пиролиза следующие: СН4+2О2→СО2+2Н2О СН4+0,5О2→СО+Н2 2СН4→С2Н2 + ЗН2 На основании расчетов докажите, что необходимая теплота для реакции получения ацетилена выделяется при сжигании части метана.
IV. ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ДОМАШНИХ РАБОТ Работа должна быть выполнена на компьютере. В виде исключения работа может быть выполнена в рукописном варианте. Образец выполнения титульного листа контрольной работы, представлен в приложении Б. Листы контрольной работы должны быть пронумерованы. Первой страницей считается титульный лист, на котором номер не ставится. На титульном листе должна быть надпись исполнителя и дата. В конце работы должна быть подпись исполнителя и дата. В конце работы должен быть представлен список использованной литературы по правилам, определяемым ГОСТом 7.1 – 84. Рекомендуется использовать алфавитный вариант группировки литературы. Если при выполнении работы были использованы законодательные и нормативные документы и акты, то они излагаются в начале списка литературы в порядке от более значимых к менее значимым. Дополнительный справочный материал допускается помещать в приложениях. Приложения обозначаются заглавными буквами русского алфавита, начиная с А. Каждое приложение следует начинать с новой страницы и оно должно иметь заголовок. Приложения должны иметь общую с остальной частью сквозную нумерацию страниц.
V. СПИСОК ЛИТЕРАТУРЫ Основная литература 1. Грей Ф. Добыча нефти/Пер. с англ. З.П. Свитнько.-М.: Олимп-Бизнес, 2007.-416 с.: ил.-(Для профессионалов и неспециалистов). 2. Вержичинская С.В. Химия и технология нефти и газа: Учебное пособие/С.В. Вержичинская, Н.Г. Дигуров, С.А. Синицин.2-е изд., испр. и доп. - М.: Форум: 2009.-400 с.: ил.-(Профессиональное образование). 3. Никитин Е.Е. Ресурсосберегающие технологии: учеб. пособие. – СПб.: СПбГИЭУ, 2009. – 158 с. 4. Карпов К.А. Технологическое прогнозирование развития химических производств: Учебное пособие. СПб, СПбГИЭУ, 2009. – 275 с. Дополнительная литература 1. Мстиславская Л.П. Основы нефтегазового производства: Учебное пособие/Министерство образования РФ; РГУ нефти и газа им. И.М. Губкина; Л.П.Мстиславская, М.Ф.Павлинич, В.П.Филиппов.-3-е изд., испр. и доп.-М.: Изд-во "Нефть и газ" РГУ нефти и газа им. И.М. Губкина, 2005.-276 с. 2. Коршак А.А. Ресурсосберегающие методы и технологии при транспортировке и хранении нефти и нефтепродуктов: Учебное пособие.- Уфа: ДизайнПолиграфСервис, 2006.-192 с.: ил. 3. Программа энергосбережения в ОАО «Газпром» на 2004-2006г.г. в 3-х кн. М.: ООО «ИРЦ Газпром», 2004. 4. Ресурсосберегающая техника и технология при обустройстве и эксплуатации нефтяных месторождений. Тр. Гипровостокнефти., Куйбышев, 1989.-137с. 5. Ресурсология: В 3-х частях (под ред. В.Р. Богатарова/Н.Новгород: Изд. Волго-Вят. акад. Гос. службы, 1999. 6. Бардик Д.Л. Нефтехимия=Petrochemicals in Nontechnical language: Пер. с англ./Д.Л.Бардик, У.Л.Леффлер.-3-е изд., перераб. и доп.-М.: ЗАО "Олимп-Бизнес", 2007.-496 с.: ил.-(Для профессионалов и неспециалистов). 7. Вержичинская С.В. Химия и технология нефти и газа: Учебное пособие/С.В. Вержичинская, Н.Г. Дигуров, С.А. Синицин.-М.: Форум: Инфра-М, 2007.-400 с.: ил.-(Профессиональное образование). 8. Интеллектуализация предприятий нефтегазохимического комплекса: экономика, менеджмент, технология, инновации, образование / Под общ. ред. И.А. Садчикова, В.Е. Сомова. – СПб.: СПбГИЭУ, 2006. - 762с. 9. Стратегические приоритеты российских нефтеперерабатывающих предприятий/Сомов В.Е., Садчиков И.А., Шершун В.Г., Кореляков Л.В.;Под ред. В.Е.Сомова.-М.: ОАО "ЦНИИТЭ-нефтехим", 2002.-292 с. Приложение 1 Лист регистрации изменений
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 2442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.75 (0.012 с.) |




 ; Δt1=1200 К - 630 К = 570 К
; Δt1=1200 К - 630 К = 570 К ; Δt2=620 К - 380 К = 240 К
; Δt2=620 К - 380 К = 240 К
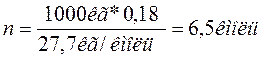

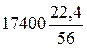 = 6960 м3/ч
= 6960 м3/ч = 30933 м3/ч,
= 30933 м3/ч, = -0,7943
= -0,7943
 =0,0071: 0,0079 = 0,9 м или 900*0,001 =0,9 м
=0,0071: 0,0079 = 0,9 м или 900*0,001 =0,9 м