
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчёт материальных балансовСодержание книги Поиск на нашем сайте
Пример 1. Составьте материальный баланс процесса нейтрализации азотной кислоты аммиаком на 1т нитрата аммония, (аммиачной селитры). Концентрация азотной кислоты 55%, газообразного аммиака—100%, нитрата аммония—85%. Потери-аммиака и азотной кислоты—1%. Решение. Нитрат аммония получают по реакции нейтрализации: NH3.+ HNOs=NH4NO3 + QP. Молекулярные массы Mr(NH3)=17, Mr(HNO3)=63, Mr(NH4NO3)=80 Рассчитываем приход. В. соответствии с уравнением 1а на 1 кмоль NH3 образуется 1 кмоль NH4N03. Масса аммиака, необходимая для производства 1 т NH4NO3 (100%): AT
С учетом потерь производства:
Aпр=212,5·1,01=214,6 (кг)
Определяем массу азотной кислоты (100%-ной), необходимой для производства 1т NH4NO3 (AT):
АТ
Определяем Апр-массу азотной кислоты с учетом потерь производства и концентрации HNO3:
Апр=
С азотной кислотой поступает вода:
1446,2-795,4=640,8(кг)
Общая масса реагентов, поступивших на нейтрализацию:
214,6+1446,2=1660,8(кг)
Определяем расход 85%-ного раствора нитрата аммония, получается:
1000:0,85=1176,47(кг). Потери HN3 составляют:
795,-787,5=7,9(кг) Масса испарившейся воды (соковый пар) составляет:
1660,8-(1176,47+2,1+7,9)=474,33(кг) Результаты расчётов сведены в таблицу. Таблица 2 Материальный баланс процесса нейтрализации азотной кислоты аммиаком
Пример 2. Составьте упрощенный материальный баланс производства этилового спирта прямой гидратацией этилена. Состав исходной парогазовой смеси (в % по объёму): этилен – 60, водяной пар – 40. Степень гидратации этилена – 5%.Расчет вести на 1 т этилового спирта. Побочные реакции и давление не учитывать. Решение. Получение этилового спирта прямой гидратацией этилена осуществляется при температуре 560К и давлении 80·105Па по реакции, протекающей по уравнению CH2=CH2+H2O↔C2H5OH+Qр Молекулярные массы: Mr(C2H4)=28, Mr(H2O)=18, Mr(C2H5OH)=46 Приход. Определяем теоретический расход этилена:
АТ Тогда практический расчёт этилена с учетом степени превращений составит: 608,7:0,05=12174(кг) или Находим объём водяного пара в парогазовой смеси:
Расход. Определяем, сколько водяного пара израсходовано на гидратацию: 9739,3·0,05=486,97(м3) Находим избыток водяного пара (проскок): 6492,8-486,97=6005,8 (м3) или Рассчитываем массу непрореагировавшего этилена: 12174-608,7=11565,3 (кг) или Полученный данные сводим в таблицу.
Таблица 3 Материальный баланс производства этилового спирта прямой гидратацией этилена
Расчёт тепловых балансов Пример 1. Один из методов получения ацетилена – термоокислительный крекинг (пиролиз) метана. Вычислите стандартную теплоту этой реакции при температуре 298К. Решение. Схема реакции термоокислительного пиролиза метана: 11CH4+5O2→2C2H2+6CO+18H2+CO2+2H2O Рассчитаем ΔН реакции пиролиза. Энтальпию образования вещества, участвующих в реакции, найдём в таблицах. ΔН○ кДж/моль: CH4-(-74,85); C2H2-226,75; CO – (-110,5); CO2-(-393,51); H2O - (-241,84); O2 – 0; H2 – 0. ΔН р= 2 • 226,75+6 (—110,5) + (—393,51) + 2(—241,84)—11(—74,85)= = -263,34 (кДж/Моль). Так как ΔН= - Qр , Qр=263,34 кДж/моль.
Пример 2. Рассчитайте теплоту, выделяющуюся при образовании 100 кг метилового спирта из СО и Н2. Энтальпия образования (в кДж/кмоль) составляет: СО - 110 583; Н2 — 0, метилового спирта — 201 456. Решение. Образование метилового спирта из СО и Н2 протекает по реакции, выражаемой уравнением: СО + 2H2↔СН3ОН + Qр, где Qp — тепловой эффект реакции. Так как QP= -ΔН, где ΔН — энтальпия реакции синтеза метанола, рассчитаем ΔН: ΔН = -201455- (- 110683) = -90772 (кДж/кмоль). Таким образом, Qp=90772 кДж/кмоль. Рассчитаем теплоту, выделяющуюся при образовании 100 кг метилового спирта: Q= Где 32 – молекулярная масса метилового спирта в кг.
Составьте тепловой баланс реактора синтеза этилового спирта, где протекает реакция СН2=СН2 + Н2О↔ С2Н5ОН + Qp (Qp=46090 кДж/кмоль), если исходный газ имеет состав: 40%. Н2О и 60% С2Н4, скорость его подачи в реактор-гидрататор 2000 м3/ч, температура на входе 563K, а на выходе из реактора 614К, конверсия за проход этилена 5%. Теплоемкость продуктов на входе и выходе одинакова и равна 27,1 кДж/кмоль. Побочные процессы и продукты не учитывать. Потери теплоты в окружающую среду принимаем 3% от прихода теплоты. Решение. Находим состав исходного газа: V(C2H4)=2000*0,6= 1200 м3; V(H2О)=800-1200*0,05=740 м3; Определяем состав газа на выходе из реактора: V(C2H4)=1200-1200*0,05= 1140 м3; V(H2О)=800-1200*0,05=740 м3; V(C2H5ОН)= 1200*0,05=60 м3. Находим суммарный объем газа (на выходе из реактора): V= 1140+740+60=1940 м3. Тепловой баланс: Q1+Q2=Q3+Q4 Рассчитываем приход теплоты. Физическая теплота Q1=2000/22,4*27,1*290 = 701696,5 кДж.
Теплота реакции: Q2=2000/22,4*0,6*46090*0,05=123460 кДж. ___________ Всего: ∑Qприхода=825156,5 кДж.
Определяем расход теплоты. Теплота, уносимая отходящими газами: Q3=1940/22,4*27,1*341 = 800345,4 кДж. Q4=825156,5*0,03 = 24754,7 кДж. ___________ Всего: ∑Qрасхода=825100,1 кДж.
Процесс идет с небольшим выделением теплоты.
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 4519; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.243 (0.005 с.) |

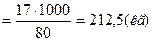

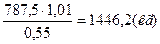

 (м3).
(м3). (м3) или
(м3) или  (кг)
(кг) (кг)
(кг) (м3).
(м3).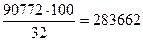 (кДж)
(кДж)


