
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ж) Формулировка первого начала термодинамики, применительно к различным изопроцессам.Содержание книги
Поиск на нашем сайте
А) Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений. Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекул. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход. Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
где · · Эта формула является математическим выражением первого начала термодинамики Для квазистатических процессов выполняется следующее соотношение:
где · · · · · Внутреннюю энергию тела можно увеличить, совершая над телом работу.Если же работу совершает само тело, то его внутренняя энергия уменьшается. Внутреннюю энергию тел можно изменить путем теплопередачи. Процесс изменения внутренней энергии без совершения работы над телом или самим телом называется теплопередачей.
Сте́пени свобо́ды — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы. Дело в том, что нас прежде всего интересует полная энергия, приходящаяся на степень свободы. А у каждой колебательной степени свободы имеется как кинетическая, так и потенциальная энергия. Классическая теорема о распределении энергии по степеням свободы[2] гласит: при термодинамическом равновесии кинетическая энергия в среднем равномерно распределяется по всем степеням свободы, по kT /2 на каждую степень свободы. При этом на каждую степень свободы, имеющую и потенциальную энергию (зависящую от данной координаты), потенциальная энергия также добавляется к полной энергии системы, а для колебательных степеней свободы средняя кинетическая и средняя потенциальная энергия равны (это утверждение является точным для гармонических осцилляторов, однако является хорошим приближением и при некотором ангармонизме). Таким образом, оказывается, что при вычислении внутренней энергии системы каждая колебательная степень свободы учитывается дважды. Поэтому иногда, для простоты подсчетов используют формулу
где под Таким образом, в статистической физике нередко под степенями свободы понимают координаты не в конфигурационном пространстве, а в фазовом пространстве, т.е. считают за различные степени свободы обобщенные координаты и обобщенные импульсы. В этом случае вносят одинаковый в классическом приближении (т.е. с некоторыми оговорками - просто при достаточно высоких температурах) вклад в полную энергию - по Формула внутренней энергии идеального газа:
и прямо связанная с ней формула для средней энергии молекулы идеального газа
где
Б) Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики Всего существует три простых (элементарных) вида передачи тепла: · Теплопроводность · Конвекция(явление переноса теплоты в жидкостях или газах, или сыпучих средах потоками вещества.) · Тепловое излучение
В) Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние. Единица измерения в Международной системе единиц (СИ): Джоуль. Г) Механический эквивалент тепла — количественное соотношение между механической и тепловой энергией. Это универсальная газовая постоянная(R). Опытным путём найдено, что, затрачивая 427 кГм, можно получить 1 ккал тепла. Эта величина (427 кГм(кГм=9,8 дж)), эквивалентная 1 ккал, и называется механическим эквивалентом тепла. Наоборот, затрачивая 1/427 ккал тепла, можно совершитьработу в 1 кГм. Эта обратная величина называется тепловым, или термическим эквивалентом работы. В Международной системе единиц механический эквивалент тепла равен единице, т. к. в этой системе как для механической работы, так и для количества теплоты принята одна и та же единица измерения - джоуль. Д) В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.). Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Изменение полной энергии системы в квазистатическом процессе (Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.) равно количеству теплоты
Для элементарного количества теплоты
Е) Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил. Важно заметить, что В изохорном процессе (V = const) газ работы не совершает, A = 0. В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0. Первый закон термодинамики для изотермического процесса выражается соотношением Q = A. Изобара
Изохора
Изотерма
Ж) Первое начало термодинамики для частных случаев: · при изобарном процессе
· при изохорном процессе (
· при изотермическом процессе
Здесь
|
|||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 645; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.166.193 (0.006 с.) |


 — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
 — температура, измеренная в кельвинах
— температура, измеренная в кельвинах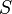 — энтропия, измеренная в джоулях/кельвин
— энтропия, измеренная в джоулях/кельвин — давление, измеренное в паскалях
— давление, измеренное в паскалях — химический потенциал
— химический потенциал — количество частиц в системе
— количество частиц в системе
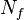 понимают количество степеней свободы не в обычном смысле, а в смысле распределения полной энергии, то есть каждая колебательная степень свободы учитывается дважды (как «колебательная кинетическая» плюс как «колебательная потенциальная», то есть в этом смысле можно говорить, что каждой колебательной степени свободы соответствуют две степени свободы в термодинамическом смысле. Остальные степени свободы (поступательные и вращательные) учитываются просто, без удвоения (так как этим видам движения соответствует нулевая — говоря точнее, пренебрежимо малая — потенциальная энергия).
понимают количество степеней свободы не в обычном смысле, а в смысле распределения полной энергии, то есть каждая колебательная степень свободы учитывается дважды (как «колебательная кинетическая» плюс как «колебательная потенциальная», то есть в этом смысле можно говорить, что каждой колебательной степени свободы соответствуют две степени свободы в термодинамическом смысле. Остальные степени свободы (поступательные и вращательные) учитываются просто, без удвоения (так как этим видам движения соответствует нулевая — говоря точнее, пренебрежимо малая — потенциальная энергия). каждая - только те из них, которые входят в выражение для энергии квадратически.
каждая - только те из них, которые входят в выражение для энергии квадратически.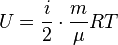 ,
, ,
, — количество степеней свободы молекулы газа,
— количество степеней свободы молекулы газа, — количество газа (
— количество газа ( — масса,
— масса,  — универсальная газовая постоянная,
— универсальная газовая постоянная,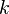 — константа Больцмана,
— константа Больцмана,
 , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества
, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества  при химическом потенциале
при химическом потенциале  [3], совершённой над системой внешними силами и полями, за вычетом работы
[3], совершённой над системой внешними силами и полями, за вычетом работы 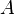 , совершённой самой системой против внешних сил
, совершённой самой системой против внешних сил .
. , элементарной работы
, элементарной работы  и малого приращения
и малого приращения  внутренней энергии первый закон термодинамики имеет вид:
внутренней энергии первый закон термодинамики имеет вид: .
.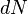 являются полными дифференциалами, а
являются полными дифференциалами, а 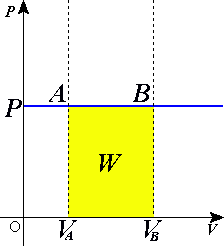


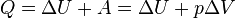
 )
)

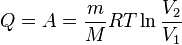
 — молярная масса газа,
— молярная масса газа,  — молярная теплоёмкость при постоянном объёме,
— молярная теплоёмкость при постоянном объёме,  — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
— давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.


