
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод. Общ. Кол-во воды сост 1350 млн.км3прибл 3 % приходится на использов чел-ом. Вода нах повсеместно: литосфера, атмосфера и гидросфера. Вода физически и химич связная. Она не участвует в круговороте воды в природе. Камни волуны тоже содержат воду. Вода в 3 агрегатных состояниях: твердое, жидкое и газообразное. В атм и из атмосферы вода выподает 70% дождей, града, снега на гидросферу, а остальные осадки вып на сушу. В круговороте не участвуют южные и северные полюса и снег с гор. Природная вода – раствор, кот содержит примеси (химич и биологич). Хим анализы готов из дистилеров воды. Основные компоненты природных вод. Хим примеси: аргонич и минеральные, котор нах в ионном, молекулярном и нерастворенном виде. Раствор газа в воде(О2, N2,H2,CO2,H2S,NH3,NO2,SO2, CH4); катион(H+,H3O+,Na+,Ca2+,K+,Mg2+, Al3+,Fe2+,Fe3+); анион(OH-,Cl-,SO42-,CO32-,HCO3-) В природных источниках имеются 7 эл-ов(Na+,K+,Ca2+,Mg2+, SO42-,Cl-,HCO3-). В приодной среде сод макро и микро элем-ты. Содержание конц NO3 воды признак позднего загрязнение, а NO2 – ранее. Арганич примеси(белки, жиры, углеводы, карбоновые к-ты, сложн эфиры, красители, СПАВы, фенолы и их производные, нефтепродукты, растворители, кислоты, альдегиды). При хлорировании воды образуются фенолы. Биологические примеси: все живые сущ гидросферы; к ним отн (млекопит, кит, морские котики, ракообразные, водоросли, микроорганизмы(рачки, черви), Гидробионт на глубине обр в толще воды – планктом. Организм обитающ на дне –бентос. Население данное – нектон. Классиф природных вод. 1 по происхождению - поверхностные (реки, озера,моря) 2 по кал-ву и хар-ру примесей: Престные,мутные,соленые,прозрачные,мягкие,жесткие,бесцветные,окрашенные. 3 по целевым назначениям: пищевая, бродильная, охлаждённая вода, поливная, лечебная, техническая 4 по величене минерализации: пресные 1000 мг/л, соленые >25г/л, солоноватые 1-25 г/л 5 по содержанию ионов: гидрокарбонатные, хлоридные Cl-, сульфатные SO2-
Сущ 49 классов воды: HCO3- - SO42- -Ca2+ -гидрокарбонатсульфаткальцевая вода. Клас-я вод в зависимости от физ-хим.св-в примесей: 1.Примеси, образующие с водой нераств. Грубо-мелкодисперсн.взвесь(частицы глины, песка, почвы) 2.Орг. и минер. Коллоиды(белки,гумус,мыла) 3.Молекулярно-растворённые в-ва:все орг. В-ва и растворённые газы. 4.В-ва диссоциирующие на ионы(соли, основания,к-ты)
Вода, как химическое соединение. H2O- гидрид кислорода. Имеет 3 агрегатных состояния, жидкое и газообр. Тв. W(Н) = 11,19% W(О)=88,81% МН2О = 18 г/моль Состав, строение молекул воды. Молекулы воды состоят из водорода и кислорода. С современных позиций строение атома:электроные облака молекул воды расположены в форме неправильного тетрайдера. Атом кислорода оказывается при этом центре, а 2 атома водорода - в противоположных углах одной из граней куба. 2 из 8 электронов атома кислорода расположены около ядра, 2 других связаны с атомами водорода, а 2 неподелённые пары электронов обр-т ветви, распол в противоположном напр по отнаш к электроном облакам водорода. Эти ветви электронных облаков явл. Оболастями состредоточения отриц. зарядов, они обусловл водородную связь между молек воды и др вещ-ми. Свойства воды. Физич св-ва – чистая вода предст собой бесцветнцю или голубоватую-зеленую, прозначная жидкость, не имеющ ни запаха ни вкуса. Теплопроводность воды очень не значит по сравнению с теплопроводн других в-в. Химические св-ва. Вода – висьма реакционно способное вещ-во. Она взаимодейств с окислами металов и не металовобр гидраты основного кислотного хар-ра. Вода обломфотернымисв-ми при взаимод со елочами, она ведет себя как кислота, а с кислотами как с осн. Активн мет взаимод с водой, с выделением водорода, напр, калий и натрий разлог воду без нагревания, магний при нагревании, железо при сильном нагрев. Вода взаимод с некот солями, вызыв процесс обменного разложения – гидролиз. Анамалии воды. Химически чистая вода обладает рядом свойств, отлич от других природных тел. Эти особые свойства известны под назв аномалии воды. 1,При нагревании от 0 до 4 объем не увеличивается, а уменьшается и максимальная плотность ее достигает не в точке замерзания 0 град, а при 4 град (точнее 3,98град). 2 вода при замерзании расширяется, а не сжимается, а все другие тела, плотность уменьшается. 3, Температура замерзания воды с увеличением давления понижается. Все аномальные явления связаны с особенностями строениями молекул воды и с их особенностью образовывать молекулярные агрегаты
Требования, предъявляемые к качеству питьевой воды. Основные показатели химич и физические качества воды. ПДК веществ и физических показателей. Вода должна быть безвредна для здоровья человека, иметь хорошие органолептические показатели и пригодна для хоз-бытовпроцесоов. Ее кач-ва должны отвечать ГОСТ(вода питьевая) общее кол-во бактерий в 1 мл неразбавленной воды, не более 100 Основные физические и химические показатели воды. Физ. к ним относ: вкус, запах, привкус, прозрачность, цветность мутность, температура, плотность и т.д. Темп, зав от поры года и от темпер в тех грунтах с кот она соприкосается. Оптимальн темпер воды идущей для питья должна не превыш 11 град С и не ниже 7’С вода с такой темпер имеет охложд и приятный вкус. Вкус, привкус – органометрич показатели кач-ва воды. Приятн и освеж вкус воде придает расствор в ней газы (кислород и углекислота), а так же немного кальция. Различ 4 вида вкуса (соленный, горький, сладкий,кислый), остальные вкусовые ощущения привкусы. Определ в сырой воде. Привкус опредсоотв признаками рыбный, хлорный, металлический и т.д. Запах Появл при цветении водоемов, водоросли во взвешенном сост потом водоросли опучкаются на дно и гниют с выдел пахнующихвеществ.запахопред по 5 бальной сис-ме. Дел на: запах от искусственпроисхождения(от попадания промышленной сточной воды); от естественного происхождения(от живущ и отмирающих в воде организмов). Характер запаха бывает (болотный, ароматный, глинистый, древесный, землистый, рыбный, травянистый, неопределенный) Мутность- присудствие в воде частиц глины, песка, ила, органических взвесей. Мутность дают нерастворимые и коллоидные вещ-ва. По ГОСТу не выше 2 мг/л. Определяют методами: нефилометр-мутномер, по кольцу, по шрифту. Прозрачность – опред по 2 методам: - по шрифту, - по кресту. Химич показатели: 1) взвешенные в-ва(крупные частицы, задерживаются бумажными фильтрами); 2) сухой остаток (хар-ет солесодержание и кол-во колойдно-расствор в воде вещ.)3) электропроводность (хим чистая вода почти не проводит электрич тока) 4) окисляемость (общее сод в воде востоновителей(неорганич и органич) реагирующ с сильными окислителями) 5) биохимичпотребл кислорода 6) проколенный остаток – сух остаток прокалив в муфельной печи. ПДК веществ и физических показателей. Предельно допустимая концентрация вещества в воде (ПДК) – это такая концентрация в ней индивидуального вещества, выше которой вода непригодна для установленного вида водопользования, а при концентрации равной или меньшей ПДК вода остается такой же безвредной для всего живого, как и вода, в которой полностью отсутствует данное вещество.НОРМЫ КАЧЕСТВА ВОДЫ устанавливают для трех видов водопользования: хозяйственно-питьевого, коммунально-бытового, рыбохозяйственного. Поэтому применительно к водной среде ПДК — это концентрация того или иного вещества в воде, при превышении которой вода не пригодна для установленного вида водопользования. Наиболее жестки ПДК для водоемов рыбохозяйственного назначения. Безопасность воды в эпидемическом отношении определяют по числу содержащихся в ней микроорганизмов (в 1 мм^ воды их должно быть не более 100) и бактерий группы кишечных палочек (в 1 л воды их должно быть не более 3). Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы,степени гидролиза и pH для такого типа солей. Как протекает гидролиз соли,образованной слабым основанием и слабой кислотой,сильным основанием и сильной кислотой?Расчет к гидролиза,h и pH для такого типа солей.У каких солей гидролиз идет до конца? Слабоеоснавание и слабая кислота: -Солислабоготипа: NH4CN,CH3COONH4,(NH4)2S,(NH4)2CO3 NH4CN: NH4OH-слабый электролит Кд=1,8∙10-5 HCN-слабая кислота Кд=7,2∙10-10 NH4CN+HOH↔NH4OH+HCN NH4+HOH↔NH4OH+H+ CN+HOH↔HCN+OH- Параллель протекают два процесса по катиону и аниону.Реакция среды-нейтральня.Определяется величиной Кд.(Кд осн>Кд.HCN) pH≥7,следовательно среда щелочная. - соли в таблице растворимости прочерк (NH4)2SiO3. Al3+,Cr3+,Fe3+ S2-,SO32-,CO32-,SiO32-rfnzd94 Al2S3, Al2SiO3,Fe2(CO3)3,Cr2(SO3)3 Соли,образованные трехосновными кислотными основаниями.Подвергютсяполному,глубокомугидролизу,образуется осадок и газообразное вещество.В уравнении реакции ставиться знак равенства. (NH4)2SiO3+HOH=NH3↑+H2O+H2SiO3(раз наSiO2 и H2O) Fe2S3+6HOH=2Fe(OH)3↓+3H2S 2FeCl3+3Na2S→ Fe2S3 +NaCl Расчет константы,степени гидролиза и pH CN3COONH4 NH4++CH3COO- +HOH↔ NH4OH+CH3COOH Kгидр= CH3COOH↔ H++ CH3COO- NH4OH↔NH4++ OH- Kд= [NH4OH]= Kгидр= h= pH= 7+ 1/2Lg Кривая падения потенциала.
При добавлении катионов и анионов мицелла будет разрушаться. Диффузный слой и гидратные оболочки разрушены. Тогда:
Озонирование воды. 2O2↔2O3 – Q Озон обладает сильными бактерицидными свойствами. Имеет высокий окислительный потенциал, легко проходит через клеточную оболочку микроорганизмов и т.д. Окисляет органические и минеральные в-ва. ПДКазона 0,1 мг на 1 м3воздуха. Доза вводимого азона в воздух сост. 0,5-4мг/л (зависит от типа воды). Недостатки процесса озонирования: большие затраты электроэнергии, усиливает процесс коррозии. 27.Удаление из воды Fe, Mn, H2SiO3 Универсальных методов очистки воды от Fe не сущ., а выбор опр-х методов зависит от результатов хим. анализа. При анализе уст-т: 1. в какой форме нах-сяFe(минер-я FeSO4(2), Fe(HCO3)2, Fe2(SO4)3Fe(OH)3- гидрозоль, гуматы железа и орган.форма). 2. примеси воды, 3. уст-т требуемую эф-ть очистки воды, вода для питья 0,3-0,5 мг/л, для крошения для производства лекарств, пищевая. В хим. лабор. Производят пробное обезжелезивание. Исп-т методы фильтрации с реагентами-окислителями. А если в воде сод-ся только гуматы железа, то треб-сянеск-ко способов обезжелез-я. Способы обезж-я: физич-е, реагентные, аэриров-е, озониров-е, хлорир-е, известков-е, катионир-е, коагулиров-е, фильтрование(окисл-е). Физико-хим. процессы: окислит-восстан-е, ионный обмен, образ-е осадков, коллоидов, абсорбция, адсорбция, хемосорбция, седиментация(осаждение нераств-х частиц). Схема аэрации воды: воду насыщ-т О2. Процесс протекает быстро, если рН=7,5, конц-я железа общего 10 мг /л, а если 2-валентной формы-70%. Процесс обезжилез-я мешает повышения кисл-ть, CO2 агрессивная, H2S много, высокая окисл-ть. Сод-яFe(2+) окисл-ся до Fe(3+) и в виде осадка Fe(OH)3 оседают на дно фильтра, устран-ся форма железа. При аэрации прот-т гидролиз Fe(HCO3)2+ 2H2O«Fe(OH)2+2H2CO3 4Fe2+(OH)2+O2+2H2O®4 Fe3+(OH)3¯(бурый ос-к). Технолог-я схема Н2О®аэрация О2возд.®отстаив-е осаждение®фильтр-е через песч-й фильтр. Если в ПВ сод-ся устойчивые формы гуматы, то О2возд. не может окислить и треб-ся более сильные окисл-ли. Технол-я схема: Н2О®аэрация О2возд.®отстаив-е осаждение®фильтр-е Известков-е, коагулир-е К воде доб-т известковое молоко Са(ОН)2 и удал-сяFeSO4. FeSO4 + Са(ОН)2 =Fe(OH)2+CaSO4. 4Fe(OH)2+O2+2H2O®4Fe(OH)3¯(бурыйос-к). Al2(SO4)3, AlCl3, FeCl3, FeSO4. FeCl3+(AlCl3+NaOH)- смеш. коагул-т. Алюминий образ-т коллоид, где гранула несёт отриц-й заряд, а Fe –полож-й. Примеси ПВ имеют отриц-й заряд.FeCl3®Fe3++3Cl-, NaAlO2®Na++AlO2- Строение гидрозоля [mFe(OH)3∙nFe3+ ∙3(n-x)Cl-∙yH2O]3x+ 3x∙Cl-∙zH2Oý0 Строение гидрозоля Al [(Al(OH)3)m∙nAlO2-(n-x)Na+∙yH2O]x-∙xNa+∙zH2O}- Т. о. образ-ся гидрозоли с зарядом+и – и протекает совместная коагуляция. Техн-я схема: H2O®аэриров-т®известков-е Ca(OH)2®коагулир-е соли Al, Fe.®отстаив-е®фильтрац-я. Фильтр-е через фильтры -“чёрный песок”, взвеш-й фильтр. -фильтр-е через кварцевый песок. 1.чёрный песок: фильтр зап-т песком ср крупности и проп-т р-р 2-5% KMnO4. Образ-сяMnO4 ®песок становится чёрным, бурым или исп-т прир. минерал-пиролюзит. 2.взвеш. фильтр, готовят высокодисперсную суспензию CaCO3 +(AlCl3+NaOH) 100в.ч.16в.ч. FeSO4+ CaCO3®FeCO3+CaSO4 FeCO3+2H2O=Fe(OH)2 + H2CO3 4Fe(OH)2 +O2 + 2H2O ®4Fe(OH)3 4FeSO4+ O2 +6 H2O+4CaCO3®4Fe(OH)3¯ + 4CaSO4+4CO2 AlCl3 образ-т гидрозоль, Fe(OH)2¯ - образ-т коллоид. Техн-я схема: H2O®аэриров-т®хлорир-е®фильтр-е через взвеш-е фильтр®отстаив-е®фильтрац-я через песч. фильтр. Метод катионного обмена Исп-т катионид Са2+R2, удал-ся 3-х валентная форма Fe. Fe2(SO4)3+ 3Са2+R2®2FeR3+3CaSO4 Fe2SO4 +CaR2-®FeR+ CaSO4 Техн-ясхема: H2O®аэриров-т®хлорир-е®катионир-е®отстаив-е®фильтрац-я через песч. фильтр. Доза ост-гоFe 0,1-0,5мг/л. Mn в ПВ нах-ся в виде Mn2+, MnCl2, MnSO4, MnOH+, MnOHCl. Удал-еMn2+ из воды осущ-ся в виде Mn(OH+)4 и MnO2. Техн-я схема: H2O®аэриров-т®хлорир-е®окисл-е®коагулир-е®отстаив-е®фильтрац-я через песч. фильтр. Хим. процессы прот-т с большой скоростью, если рН=8,5 и кат-р,О2- окисл-ль. Техн-я схема: H2O®аэриров-т®®известков-е®”чёрн. песок” MnO2®отстаив-е®фильтрац-я через песч. фильтр. Воду аэрируют О2возд.+ Ca(OH)2 и фильтр-т через “чёрный песок” при этом MnO2ок-сякисл-м воздуха и обр-т ок-ль MnO2+0,5O2+ Ca(OH)2®CaMnO4 CaMnO4+MnCl2®2MnO2+CaCl2. Обескремнивание воды Кремний в прир. воде нах-ся виде Na2SiO3, NaHSiO3, H2SiO3 золь. Сод-е в воде Siсост-т 1-50 мл гр/л. Обескремнивание необходимо: если вода для производства лекарств, целлюлозы, питания паровых котлов. Методы удаления Si: Реагентный -исп-т известкование воды, содово-известковый метод. При этом происходит умягчение воды, удаляется Si в виде KSiO3, MgSiO3(удаляется Fe, Mn). Процесс протекает более эффективно, если исп-ть избытки реагентов. Фильтрац-й - воду пропускают через взвешан. фильтр. CaCO3 +(AlCl3+NaOH) 100в.ч.16в.ч. Исп-т фильтрование через зернистый песок. Подкисление воды: Na2SiO3+2HCl®H2SiO3+2NaCl Образ-ся гидрофильный гидрозоль. Ионно-обменный- исп-т метод ионирования воды:HSiO3-, 2R+OH-, R+Cl-, Na2SiO3+ RCl®RCl+ R2SiO3+2NaCl.Глубокое удаление кремния. Коагулирование- исп-т соли-коагулянты: FeSO4∙7H2O(железный купорос), Fe2(SO4)3∙18 H2O(cульфатFe-3), Al2(SO4)∙24H2O, FeCl3∙6 H2O, Fe(OH)3. Удаляется Fe, Si, Mn. Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод. Общ. Кол-во воды сост 1350 млн.км3прибл 3 % приходится на использов чел-ом. Вода нах повсеместно: литосфера, атмосфера и гидросфера. Вода физически и химич связная. Она не участвует в круговороте воды в природе. Камни волуны тоже содержат воду. Вода в 3 агрегатных состояниях: твердое, жидкое и газообразное. В атм и из атмосферы вода выподает 70% дождей, града, снега на гидросферу, а остальные осадки вып на сушу. В круговороте не участвуют южные и северные полюса и снег с гор. Природная вода – раствор, кот содержит примеси (химич и биологич). Хим анализы готов из дистилеров воды.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.56.78 (0.009 с.) |


 Kд=
Kд= 
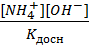 [CH3COOH]=
[CH3COOH]= 
 =
=  =
= 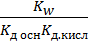
 ,концентрация соли не влият на степень гидролиза,Кгидр и pH
,концентрация соли не влият на степень гидролиза,Кгидр и pH - 1/2Lg
- 1/2Lg 






