Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы обеззараживания воды. Хлорирование воды. Характеристика. Что такое активный хлор, остаточный хлор, оптимальная доза хлора. Кривая хлороёмкости воды. Как ее получить. ⇐ ПредыдущаяСтр 3 из 3
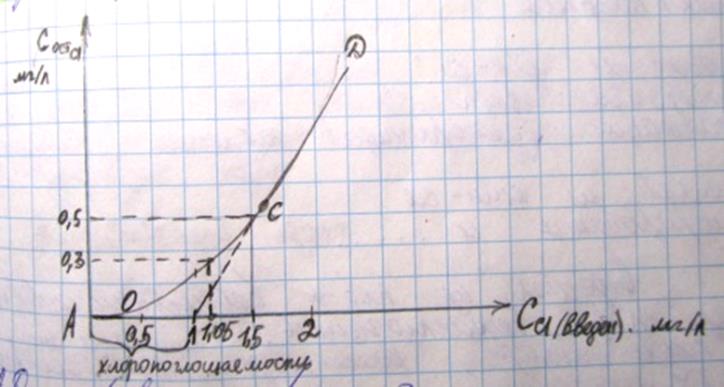
Обеззараживание или дезинферция – удаление из воды патогенных форм микроорганизмов. При обеззараживании используют методы: 1. физические (озонирование, ультразвук, ультрафиолет.лучи, кипячение). 2. Химич. Реагенты (хлорсодержащие в-ва, ионы серебра, меди, золота). Обеззараживание воды методом хлорирования – хлор окисляет в-ва, кот.нах-ся в цитоплазме и бактерии погибают. На окисление этих веществ затрачивается небольшое кол-во введенного хлора. Большая часть тратится на окисление восстановителей, нах-ся в воде. Fe2+→Fe3+; H2S→S+6; SO32-→SO42-; Mn2+→Mn4+ Воду хлорируют: CI2 CIO2 NaCIO Ca(CIO)2 - гидрохлоридкальция CI2+H2O↔HCI-1+HCIO (хлорноватистая к-та) Хлорная вода – это смесь HCI, HCIO, CI2. При хлорировании воды, у кот.имеется щёлочность, происходит реакция: CI2+NaOH→NaCI+NaCIO-+ H2O CI02+NaOH→NaCI-1+NaCIO3+H2O Все хлоросодержащие реагенты содержат активный хлор – это кол-во молекулярного хлора, кот.отвечает окислительной способности данного соединения относительно восстановителя KI в кислой среде. Рассчит-ют по ф-ле: Сакт%СI= В лаборатории проводят пробное хлорирование используя метод йодометрии: H2O+CIреагент+KIизбыт+H+→I2+ крахмал I-(обесцвечивание) CI2+2KI→I2+2KCI CIO-+KI+H+→I2+KCI+H2O I2+2Na2S2O3→(крахмал)→2NaI+Na2S2O6 Пробное хлорирование в лаборатории В 6 колб отбирают по 100мл воды, и по 0,5;1;1,5;2;3;5; CIреагента соотв-нно в каждую колбу. После 30 мин хлорирования добавлябтKI. KI+H2SO4 (в каждую колбу). Каждую колбу оттитровывают тиосульфатом натрия. По ф-ле определим дозу остаточного хлора: ДCIост= По полученным данным строим график: доза введенного хлора от дозы остаточного хлора и строим кривую хлороёмкости воды:
АД- кривая хлороемкости АО- доза остаточного хлора АС- протекает процесс хлорирования СД- прямая линия – процессы окисления не протекают. Доза введенного хлора = дозе остаточного хлора. Доза остаточного хлора после хлорирования 0,3-0,5мг/л. Оптимальная доза хлора – 0,3 мг/л. ДCIопт=1,05мг/л
Виды хлорирования. Озонирование воды. Олигодинамия. Виды хлорирования: 1. Нормальное (если вода забирается из надежных водоисточников и вода имеет хорошие физико-химич. показатели). Доза остат. Хлора 0,3-0,5 мг/л. 2. Кратковременное и прериодическоет(вводят большие дозы хлора и хлорируют 3-30мин с интервалами и несколько раз). Хлорируют фильтры, резервуары, вводимые в эксплуатацию участки водопроводной сети.
3. Перехлорирование – добавляют большие дозы хлора: 1-10 мг/л, устраняют запахи, цвет, привкус. 4. Дехлорирование – удаление из воды избыточного хлора. В воду добавляют кислород, сульфиты, аммиак, SO2. 5. Постхлорирование – после всех видов снова хлорируют. Комбинированные методы хлорирования: Хлорирование с манганированием, хлор серебряный, хлор медный. Комбинир. Методы исп-т при обеззараживании больших объёмов воды. Олигодинамия – обеззараживание воды ионами серебра и меди. Ионы меди добавляют медный купорос, соли серебра. Они убивают патогенные микроорганизмы, кишечную палочку, улучшается цветность, вкус, привкус воды. Озонирование воды. 2O2↔2O3 – Q Озон обладает сильными бактерицидными свойствами. Имеет высокий окислительный потенциал, легко проходит через клеточную оболочку микроорганизмов и т.д. Окисляет органические и минеральные в-ва. ПДКазона 0,1 мг на 1 м3воздуха. Доза вводимого азона в воздух сост. 0,5-4мг/л (зависит от типа воды). Недостатки процесса озонирования: большие затраты электроэнергии, усиливает процесс коррозии. 27.Удаление из воды Fe, Mn, H2SiO3 Универсальных методов очистки воды от Fe не сущ., а выбор опр-х методов зависит от результатов хим. анализа. При анализе уст-т: 1. в какой форме нах-сяFe(минер-я FeSO4(2), Fe(HCO3)2, Fe2(SO4)3Fe(OH)3- гидрозоль, гуматы железа и орган.форма). 2. примеси воды, 3. уст-т требуемую эф-ть очистки воды, вода для питья 0,3-0,5 мг/л, для крошения для производства лекарств, пищевая. В хим. лабор. Производят пробное обезжелезивание. Исп-т методы фильтрации с реагентами-окислителями. А если в воде сод-ся только гуматы железа, то треб-сянеск-ко способов обезжелез-я. Способы обезж-я: физич-е, реагентные, аэриров-е, озониров-е, хлорир-е, известков-е, катионир-е, коагулиров-е, фильтрование(окисл-е). Физико-хим. процессы: окислит-восстан-е, ионный обмен, образ-е осадков, коллоидов, абсорбция, адсорбция, хемосорбция, седиментация(осаждение нераств-х частиц). Схема аэрации воды: воду насыщ-т О2. Процесс протекает быстро, если рН=7,5, конц-я железа общего 10 мг /л, а если 2-валентной формы-70%. Процесс обезжилез-я мешает повышения кисл-ть, CO2 агрессивная, H2S много, высокая окисл-ть. Сод-яFe(2+) окисл-ся до Fe(3+) и в виде осадка Fe(OH)3 оседают на дно фильтра, устран-ся форма железа. При аэрации прот-т гидролиз Fe(HCO3)2+ 2H2O«Fe(OH)2+2H2CO3
4Fe2+(OH)2+O2+2H2O®4 Fe3+(OH)3¯(бурый ос-к). Технолог-я схема Н2О®аэрация О2возд.®отстаив-е осаждение®фильтр-е через песч-й фильтр. Если в ПВ сод-ся устойчивые формы гуматы, то О2возд. не может окислить и треб-ся более сильные окисл-ли. Технол-я схема: Н2О®аэрация О2возд.®отстаив-е осаждение®фильтр-е Известков-е, коагулир-е К воде доб-т известковое молоко Са(ОН)2 и удал-сяFeSO4. FeSO4 + Са(ОН)2 =Fe(OH)2+CaSO4. 4Fe(OH)2+O2+2H2O®4Fe(OH)3¯(бурыйос-к). Al2(SO4)3, AlCl3, FeCl3, FeSO4. FeCl3+(AlCl3+NaOH)- смеш. коагул-т. Алюминий образ-т коллоид, где гранула несёт отриц-й заряд, а Fe –полож-й. Примеси ПВ имеют отриц-й заряд.FeCl3®Fe3++3Cl-, NaAlO2®Na++AlO2- Строение гидрозоля [mFe(OH)3∙nFe3+ ∙3(n-x)Cl-∙yH2O]3x+ 3x∙Cl-∙zH2Oý0 Строение гидрозоля Al [(Al(OH)3)m∙nAlO2-(n-x)Na+∙yH2O]x-∙xNa+∙zH2O}- Т. о. образ-ся гидрозоли с зарядом+и – и протекает совместная коагуляция. Техн-я схема: H2O®аэриров-т®известков-е Ca(OH)2®коагулир-е соли Al, Fe.®отстаив-е®фильтрац-я. Фильтр-е через фильтры -“чёрный песок”, взвеш-й фильтр. -фильтр-е через кварцевый песок. 1.чёрный песок: фильтр зап-т песком ср крупности и проп-т р-р 2-5% KMnO4. Образ-сяMnO4 ®песок становится чёрным, бурым или исп-т прир. минерал-пиролюзит. 2.взвеш. фильтр, готовят высокодисперсную суспензию CaCO3 +(AlCl3+NaOH) 100в.ч.16в.ч. FeSO4+ CaCO3®FeCO3+CaSO4 FeCO3+2H2O=Fe(OH)2 + H2CO3 4Fe(OH)2 +O2 + 2H2O ®4Fe(OH)3 4FeSO4+ O2 +6 H2O+4CaCO3®4Fe(OH)3¯ + 4CaSO4+4CO2 AlCl3 образ-т гидрозоль, Fe(OH)2¯ - образ-т коллоид. Техн-я схема: H2O®аэриров-т®хлорир-е®фильтр-е через взвеш-е фильтр®отстаив-е®фильтрац-я через песч. фильтр. Метод катионного обмена Исп-т катионид Са2+R2, удал-ся 3-х валентная форма Fe. Fe2(SO4)3+ 3Са2+R2®2FeR3+3CaSO4 Fe2SO4 +CaR2-®FeR+ CaSO4 Техн-ясхема: H2O®аэриров-т®хлорир-е®катионир-е®отстаив-е®фильтрац-я через песч. фильтр. Доза ост-гоFe 0,1-0,5мг/л. Mn в ПВ нах-ся в виде Mn2+, MnCl2, MnSO4, MnOH+, MnOHCl. Удал-еMn2+ из воды осущ-ся в виде Mn(OH+)4 и MnO2. Техн-я схема: H2O®аэриров-т®хлорир-е®окисл-е®коагулир-е®отстаив-е®фильтрац-я через песч. фильтр. Хим. процессы прот-т с большой скоростью, если рН=8,5 и кат-р,О2- окисл-ль. Техн-я схема: H2O®аэриров-т®®известков-е®”чёрн. песок” MnO2®отстаив-е®фильтрац-я через песч. фильтр. Воду аэрируют О2возд.+ Ca(OH)2 и фильтр-т через “чёрный песок” при этом MnO2ок-сякисл-м воздуха и обр-т ок-ль MnO2+0,5O2+ Ca(OH)2®CaMnO4 CaMnO4+MnCl2®2MnO2+CaCl2. Обескремнивание воды Кремний в прир. воде нах-ся виде Na2SiO3, NaHSiO3, H2SiO3 золь. Сод-е в воде Siсост-т 1-50 мл гр/л. Обескремнивание необходимо: если вода для производства лекарств, целлюлозы, питания паровых котлов. Методы удаления Si: Реагентный -исп-т известкование воды, содово-известковый метод. При этом происходит умягчение воды, удаляется Si в виде KSiO3, MgSiO3(удаляется Fe, Mn). Процесс протекает более эффективно, если исп-ть избытки реагентов. Фильтрац-й - воду пропускают через взвешан. фильтр. CaCO3 +(AlCl3+NaOH) 100в.ч.16в.ч. Исп-т фильтрование через зернистый песок. Подкисление воды: Na2SiO3+2HCl®H2SiO3+2NaCl Образ-ся гидрофильный гидрозоль. Ионно-обменный- исп-т метод ионирования воды:HSiO3-, 2R+OH-, R+Cl-, Na2SiO3+ RCl®RCl+ R2SiO3+2NaCl.Глубокое удаление кремния. Коагулирование- исп-т соли-коагулянты:
FeSO4∙7H2O(железный купорос), Fe2(SO4)3∙18 H2O(cульфатFe-3), Al2(SO4)∙24H2O, FeCl3∙6 H2O, Fe(OH)3. Удаляется Fe, Si, Mn.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 545; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.15.149 (0.021 с.) |
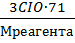 ≈38%
≈38%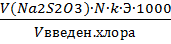 , мг/л
, мг/л