
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електричні методи дослідження свердловинСодержание книги
Поиск на нашем сайте
Методи природного електричного поля Фізичні основи методу потенціалів самочинної поляризації Методи потенціалів самочинної (власної) поляризації гірських порід базуються на вивченні природного стаціонарного електричного поля в свердловинах, утворення якого пов’язане з фізико-хімічними процесами, що відбуваються на поверхні розділу свердловина-порода та між пластами різної літології (Рис. 2.1). На поверхні розділу утворюються подвійні електричні шари, різні потенціали яких утворюють певні величини напруженості електричного поля між гірськими породами та свердловиною.
а – при r ф> r в; б – при r ф< r в; 1 – вміщуючі породи (глини); 2 – піщаний пласт; 3 – подвійний електричний шар; I – електричний контур; II – графік статистичного потенціалу ПС – E s; III – крива потенціалу U ПС; IV – лінії струму. E 0,1; E 0,3; E 1,2; E 2,3; E 2,0; – е.р.с. подвійних електричних шарів відповідно на поверхні розділу свердловина – вміщуючи породи, вміщуючи породи – пласт, свердловина – пласт Рисунок 2.1 – Виникнення дифузійно-адсорбційної електрорушійної сили у свердловині
Потенціали власної поляризації порід утворюються в результаті наступних фізико-хімічних процесів: 1) дифузія солей із пластових вод в промивну рідину та навпаки, а також адсорбція іонів на поверхні мінеральних частинок гірської породи; 2) фільтрації вод із промивної рідини в породи і пластових вод у свердловину; 3) окисно-відновних реакцій, що проходять в породах і на їх контакті з промивною рідиною та металами. Дифузійно-адсорбційні потенціали. Виникнення в свердловинах природної електрохімічної активності визначається в першу чергу процесами дифузії електролітів. На контакті розчинів електролітів пластової води концентрації С в і фільтрату промивної рідини концентрації С ф неоднакової мінералізації та різного хімічного складу виникає дифузійна електрорушійна сила, яка визначається формулою:
де K д – коефіцієнт дифузійної електрорушійної сили:
де l k, l a – відповідно, рухомість катіона та аніона; n k, n a, z k, z a – відповідно, число катіонів і аніонів, на які дисоціює одна молекула електроліту; Т – абсолютна температура, К; R – універсальна газова стала, яка рівна 8.3 Дж/градус·м; F – число Фарадея, рівне 96500 Кл. Рівняння (2.1) справедливе для ідеальних розчинів досить низької концентрації. У випадку реальних електролітів у виразі (2.1) необхідно замість концентрації С в і С ф використовувати значення активності a в= f 1· C в і a ф= f 2· C ф, де f 1, f 2 – коефіцієнти активності, які враховують вплив сил взаємодії між іонами в реальних розчинах. Коефіцієнт активності “виправляє” концентрацію так, щоб рівняння, які отримані для ідеальних електролітів, були справедливі і для реальних розчинів. Тільки в сильно розведених розчинах активність рівна концентрації розчину, тобто коефіцієнт активності рівний одиниці. Для реальних розчинів вираз (2.1) набуде виду:
При контакті порід різного літологічного складу або розчину та породи виникає дифузійно-адсорбційна різниця потенціалів:
де K дa= K д+ A дa – коефіцієнт дифузійно-адсорбційної електрорушійної сили; A дa – дифузійно-адсорбційна активність породи. Величина А дa і E дa визначаються хімічним складом і концентрацією контактуючих розчинів, речовинним і гранулометричним складом породи, густиною укладання частинок і мірою водонасичення (нафтогазонасичення) колектора, температурою та тиском в свердловині. Дифузійно-адсорбційна активність розраховується за формулою:
Фізична суть дифузійно-адсорбційної активності полягає в тому, що її величина визначається різницею коефіцієнтів дифузійно-адсорбційної електрорушійної сили гірської породи та дифузійної електрорушійної сили даної пари розчинів питомих опорів r ф, r в. Фільтраційні потенціали виникають у випадку руху рідини через гірські породи при певних умовах. На поверхні розділу капіляра, що моделює одиничну пору породи, з розчином електроліту формується подвійний електричний шар (Рис. 2.2). Зовнішня його частина утворена дифузним шаром іонів, товщина якого тим більша, чим менша концентрація розчину. Якщо між кінцями капіляру створити різницю тисків D р, то при русі через капіляр рідина забирає частину іонів дифузійного шару, в результаті чого сам капіляр заряджається позитивно, а на його кінцях з високим тиском виникає від’ємний потенціал.
1 – від’ємний заряд; 2 – додатній заряд; 3 – скелет породи із залишковим від’ємним зарядом; I – подвійний електричний шар; II – дифузійна частина подвійного електричного шару; III – вільний електроліт Рисунок 2.2 – Схема подвійного електричного шару в капілярі (модель пори гірської породи) Величина потенціалу фільтрації через капіляр визначається формулою Гельмгольца:
де εр – діелектрична стала рідини; ρ р - питомий електричний опір рідини; x – електрокінетичний потенціал, який дорівнює різниці потенціалів на границі рухомої та нерухомої частин подвійного шару та вільного розчину; h – в’язкість рідини в капілярі; ∆ p тиск, під дією якого відбувається фільтрація рідини. Потенціал фільтрації для порід в свердловинних умовах визначається за формулою:
де А ф – фільтраційна активність середовища, що досліджується; m – показник ступеню, який обернено-пропорційно залежить від ємності обміну q п породи (при q п®0 величина m ®1); n – емпіричний коефіцієнт, який змінюється від 0.5 до 1; D p = p c– p пл – перепад тисків між свердловинним і пластовим. Окисно-відновні потенціали виникають в свердловинах у результаті хімічних реакцій, які відбуваються між тілами з електронною провідністю та електролітами промивної рідини та пластових вод. Окисно-відновні електрорушійні сили можуть виникати в сульфідах, кам’яних вугіллях та інших гірських породах. У нафтових і газових свердловинах, розрізи яких складені переважно піщано-глинистими та карбонатними породами, величина потенціалів власної поляризації обумовлена головним чином дифузійно-адсорбційними потенціалами, на які при відповідних умовах можуть накладатись потенціали фільтрації. Окисно-відновні потенціали для таких розрізів не характерні.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.170.38 (0.006 с.) |



 , (2.1)
, (2.1) , (2.2)
, (2.2)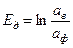 . (2.3)
. (2.3) (2.4)
(2.4) . (2.5)
. (2.5)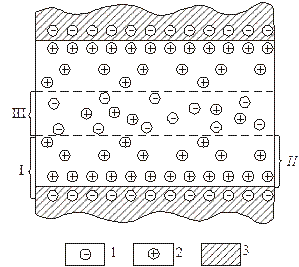
 , (2.6)
, (2.6) (2.7)
(2.7)


