
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Абдуллаев Э.Г., Бойко И.П., Татмышевский К.В.Содержание книги
Поиск на нашем сайте
Ультразвуковая диагностика В медицине Учебное пособие
Владимир 2002 УДК 615.83(075.8) А13
Рецензенты: Кандидат медицинских наук, доцент заведующий кафедрой терапии А.И. Морозов
Доктор медицинских наук, профессор Владимирского государствен- Н.П. Ларионов
Печатается по решению редакционно-издательского совета
Абдуллаев Э.Г., Бойко И.П., Татмышевский К.В. А13 Ультразвуковая диагностика в медицине: Учеб. пособие / Владим. гос. ун-т. Владимир, 2002. 213 с. ISBN 5-89368-322-6
Рассмотрены основные особенности физики ультразвука, структуры приборов для ультразвуковых исследований медленного и быстрого сканирования. Приведены примеры ультразвуковых исследований анатомического строения паренхиматозных и полых органов брюшной полости, почек, мочевого пузыря и других. Предназначено для студентов, обучающихся по специальностям: 190500 – биотехнические и медицинские аппараты и системы, 190600 – инженерное дело в медикобиологической практике. Может быть рекомендовано для бакалавров и магистров, обучающихся по направлению 553400 «Биомедицинская инженерия». Ил. 45. Библиогр.: 4 назв. УДК 615.83(075.8)
ISBN 5-89368-322-6 © Владимирский государственный университет, 2002
ВВЕДЕНИЕ
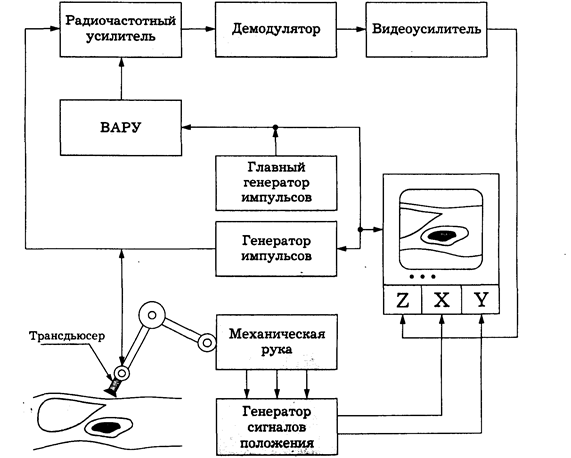
В последние годы достаточно быстро произошло становление методов ультразвукового сканирования органов брюшной полости, щитовидной железы, малого таза и др. В настоящее время четко определены возможности ультразвукового сканирования. Без аппаратов ультразвуковых исследований (УЗИ) не обходится практически ни одно лечебно-профилактичес- Наиболее часто в медицине используются следующие основные методы диагностики: 1) лучевые (рентгенографические, томографические, ультразвуковые); 2) электрографические (электрокардиография, электромиография, электроэнцефалография и т.п.); 3) клинико-биохимические (цитологические, иммуноферментные); 4) нейроэлектрические (электроакупунктура по Фоллю); 5) изотопные (сцинтиграфия, радиометрия, радиоиммунология, радиоизотопное сканирование); 6) эндоскопические (гастроскопия, колоноскопия, лапароскопия и т.п.). Ультразвуковая диагностика относится к группе лучевых методов интроскопии. Однако в отличие от рентгенографических методов УЗИ является практически безвредным методом. Генерация и регистрация УЗ волн может быть аппаратно реализована достаточно просто, а результаты представлены в реальном масштабе времени. Информация, полученная в ходе УЗ-сканирования, обрабатывается обычным персональным компьютером. Использование УЗ-аппаратуры не предъявляет особых требований к помещениям, расходным материалам, результаты диагностики получаются оперативно. По сравнению с различными видами компьютерной томографии УЗ-диагностика существенно дешевле. Кроме того, как показала практика, оказалось возможным использовать ультразвуковое сканирование для изучения строения и топографии внутренних органов в процессе изучения дисциплин «Анатомия и физиология человека» и «Основы биологии человека и животных» студентами немедицинских специальностей. Применение УЗ-сканирования для этих целей обеспечило наглядность и доходчивость подачи материала. Основы физики ультразвука Приборы медленного сканирования В настоящее время приборы медленного (ручного, сложного) сканирования представляют лишь исторический интерес. Морально они умерли с появлением приборов быстрого сканирования (приборов, работающих в реальном времени). Однако их основные компоненты сохраняются и в современных приборах (естественно, с использованием современной элементной базы). Сердцем прибора является главный генератор импульсов
Рис. 1. Структурная схема ультразвукового аппарата Генератор импульсов посылает электрические импульсы на трансдьюсер, который генерирует ультразвуковой импульс и направляет его в ткани, принимает отраженные сигналы, преобразовывая их в электрические колебания. Эти электрические колебания далее направляются на радиочастотный усилитель, к которому обычно подключаются временно-амплитудный регулятор усиления (ВАРУ) и регулятор компенсации тканевого поглощения по глубине. Ввиду того, что затухание ультразвукового сигнала в тканях происходит по экспоненциальному закону, яркость объектов на экране с увеличением глубины прогрессивно падает. Использование линейного усилителя, т.е. усилителя, пропорционально усиливающего все сигналы, привело бы к переусилению сигналов в непосредственной близости от датчика при попытке улучшения визуализации глубоко расположенных объектов. Использование логарифмических усилителей позволяет решить эту проблему. Ультразвуковой сигнал усиливается пропорционально времени задержки его возвращения – чем позже вернулся, тем сильнее усиление. Таким образом, применение ВАРУ позволяет получить на экране изображение одинаковой яркости по глубине. Усиленный таким образом радиочастотный электрический сигнал подается затем на демодулятор, где он выпрямляется и фильтруется, и еще раз усиленный на видеоусилителе попадает на экран монитора. Для сохранения изображения на экране монитора необходима видеопамять. Она может быть разделена на аналоговую и цифровую. Первые мониторы позволяли представлять информацию в аналоговой бистабильной форме. Устройство, называемое дискриминатором, позволяло изменять порог дискриминации – сигналы, интенсивность которых была ниже порога дискриминации, не проходили через него и соответствующие участки экрана оставались темными. Сигналы, интенсивность которых превышала порог дискриминации, представлялись на экране в виде белых точек. При этом яркость точек не зависела от абсолютного значения интенсивности отраженного сигнала – все белые точки имели одинаковую яркость. При таком способе представления изображения – он получил название "бистабильный" – хорошо были видны границы органов и структуры с высокой отражающей способностью (например почечный синус), однако, оценить структуру паренхиматозных органов не представлялось возможным. Появление в 70-х годах приборов, которые позволяли передавать на экране монитора оттенки серого цвета, знаменовало начало эры серошкальных приборов. Эти приборы давали возможность получать информацию, которая была недостижима при использовании приборов с бистабильным изображением. Развитие компьютерной техники и микроэлектроники позволило вскоре перейти от аналоговых изображений к цифровым. Цифровые изображения в ультразвуковых установках формируются на больших матрицах (обычно 512×512 пикселов) с числом градаций серого цвета 16-32-64-128-256 (4-5-6-7-8 бит). При визуализации на глубину 20 см на матрице 512×512 пикселов один пиксел будет соответствовать линейным размерам в 0,4 мм. На современных приборах имеется тенденция к увеличению размеров дисплеев без потери качества изображения и на приборах среднего класса 12-дюймовый (30 см по диагонали) экран становится обычным явлением. Электронно-лучевая трубка ультразвукового прибора (дисплей, монитор) использует остро сфокусированный пучок электронов для получения яркого пятна на экране, покрытом специальным фосфором. С помощью отклоняющих пластин это пятно можно перемещать по экрану. При А-типе развертки (А – вместо английского слова "амплитуда" (Amplitude)) по одной оси откладывается расстояние от датчика, по другой – интенсивность отраженного сигнала. В одних приборах А-тип развертки практически не используется, в других В-тип развертки (В – вместо английского слова "яркость" (Brightness)) позволяет вдоль линии сканирования получить информацию об интенсивности отраженных сигналов в виде различия яркости отдельных точек, составляющих эту линию. М-тип (иногда ТМ) развертки (М – вместо английского слова "движение" (Motion)) позволяет регистрировать движение (перемещение) отражающих структур во времени. При этом по вертикали регистрируются перемещения отражающих структур в виде точек различной яркости, а по горизонтали – смещение положения этих точек во времени. Для получения двумерного томографического изображения необходимо тем или иным образом произвести перемещение линии сканирования вдоль плоскости сканирования. В приборах медленного сканирования это достигалось перемещением датчика вдоль поверхности тела пациента вручную.
УЛЬТРАЗВУКОВЫЕ ИССЛЕДОВАНИЯ Органов брюшной полости
Печень Ультразвуковая анатомия печени В подавляющем большинстве случаев при ультразвуковом исследовании печень визуализируется в правом подреберье, за исключением варианта инверсии внутренних органов.
При ультразвуковом исследовании в печени в большинстве случаев четко различаются все четыре доли (правая, левая, квадратная и хвостатая) (рис. 2). Анатомическими ориентирами границ между долями, выявляемыми при эхографии, служат: между правой и квадратной долями – ложе желчного пузыря; между квадратной и левой долями – круглая связка и борозда круглой связки; между квадратной и хвостатой долями – ворота печени; выемка венозной связки в виде гиперэхогенной перегородки (удвоенный листок капсулы и жировая клетчатка) – между левой и хвостатой долями. Хвостатая доля имеет в той или иной степени ярко выраженный хвостатый отросток, располагающийся на эхограммах позади от ворот печени, спереди от нижней полой вены и в латеральном направлении от основной массы хвостатой доли.
Оставшуюся часть правой доли занимает VII сегмент, который еще иногда называют "язычковым". Особенностью VII сегмента является его переход на диафрагмальную поверхность позади квадратной доли, где он практически неотличим от последней. Необходимо отметить, что четко размежевать сегменты печени при ультразвуковом исследовании не удается ввиду отсутствия явных анатомических и эхографических маркеров границ сегментов в пределах долей. Во время исследования возможно лишь выделять центральные зоны сегментов, ориентируясь на ветви воротной вены. Капсула печени отчетливо визуализируется в виде гиперэхогенной структуры, окружающей паренхиму печени, за исключением участков, прилежащих к диафрагме, где капсула не дифференцируется от последней. Контуры печени имеют достаточно ровные и четкие очертания. Поверхности печени имеют различную кривизну на разных участках. На висцеральной поверхности печени, обращенной к брюшной полости, имеется несколько вдавлений, образованных тесным прилеганием ряда органов – правой почки, печеночного изгиба толстой кишки, двенадцатиперстной кишки, желудка, правого надпочечника. Достаточно часто хорошо визуализируется круглая связка и венечная борозда, изредка – серповидная связка. Круглая связка обычно имеет вид гиперэхогенной округлой (при косом сканировании) структуры, часто дающей акустическую тень или эффект дистального ослабления эхосигнала. При продольном сканировании связка видна в виде гиперэхогенного тяжа, идущего косо в кранио-каудальном направлении снизу вверх. Венечная борозда чаще всего выявляется в виде участка втяжения на передней поверхности печени при косом сканировании. Главным образом у тучных пациентов в области борозды выявляется утолщенный слой жировой клетчатки, который, находясь в углублении борозды, может симулировать поверхностно расположенное объемное образование смешанной эхогенности и неоднородной структуры. Прочие структуры связочного аппарата печени в обычных условиях не дифференцируются и становятся доступными для идентификации только при наличии асцита или локальных скоплений жидкости. При продольном сканировании четко визуализируется нижний край печени. Угол нижнего края левой доли не превышает 45 °, правой – 75 °. Левая оконечность печени также имеет острый угол – до 45 °. В норме нижний край печени практически не выступает из-под реберной дуги и при установке датчика перпендикулярно последней акустическая тень от нее падает на нижний край печени. Исключение составляют случаи, когда имеется опущение печени без увеличения ее размеров и без особенности конституционального строения. Так, у гиперстеников нижний край печени чаще выступает на Эхография позволяет дифференцировать разнообразные трубчатые структуры, находящиеся внутри паренхимы печени. К ним в первую очередь относятся печеночные вены и их мелкие ветви, ветви воротной вены, печеночной артерии и желчевыводящие протоки. В паренхиме неизмененной печени четко прослеживаются ветви воротной вены и печеночные вены, причем отчетливая визуализация мелких (до 1 – 2 мм в диаметре) ветвей печеночных вен в ряде случаев является важным диагностическим признаком. Воротная вена делится на два крупных ствола в воротах печени – правую и левую долевые ветви, образующие характерный рисунок при косом сканировании. Сегментарные ветви воротной вены располагаются в центральных отделах сегментов печени и далее разделяются на субсегментарные ветви, характерными признаками которых является горизонтальное расположение на томограммах и наличие четко выраженных эхопозитивных стенок. Внутренний диаметр воротной вены прогрессивно уменьшается в направлении более мелких ветвей. Печеночные вены обычно представлены тремя крупными магистральными стволами – правым, средним и левым – и мелкими ветвями. Правая печеночная вена располагается в толще правой доли печени, средняя проходит в главной междолевой борозде, а левая – в толще левой доли печени. В глубине, за хвостатой долей, они впадают в нижнюю полую вену. В некоторых случаях может встретиться иной вариант – "рассыпной" тип, когда вместо трех магистральных стволов визуализируются несколько менее крупных вен. Отличительными признаками печеночных вен являются их радиальное расположение – направление от периферии в центр, "отсутствие" стенок (за исключением случаев, когда сканирующий луч проходит по направлению к стенке под углом, близким к 90 °), четкая прослеживаемость мелких ветвей (до 1 мм в диаметре) до периферии органа. Нормальный диаметр воротной вены составляет 10 – 14 мм, печеночных вен – 6 – 10 мм на расстоянии до 2 см от устьев. Диаметр нерасширенного основного ствола воротной вены в области печеночно-двенадцатиперстной связки в зависимости от конституции исследуемого составляет 10 – 14 мм. В комплекс исследования печени входит также осмотр нижней полой вены на участке ее прилегания к печени. Нижняя полая вена располагается в борозде между правой, левой и хвостатой долями. Ее поперечное сечение может иметь диаметр до 20 – 25 мм, четко видимые стенки и близкую к овальной форму. Печеночная артерия визуализируется в области ворот печени как трубчатая структура небольшого диаметра, обычно до 4 – 6 мм, с высокоэхогенными стенками. Ветви печеночной артерии могут быть выявлены в режиме в области бифуркации и долевых ветвей. Более мелкие градации обычно не дифференцируются. Возможность выявить и идентифицировать мелкие сегментарные и субсегментарные ветви печеночной артерии имеется при использовании диагностических приборов высокого класса, имеющих высокую разрешающую способность и функции цветового и спектрального доплеровского исследования. Желчевыводящие протоки печени могут дифференцироваться, только начиная с долевых. Они также имеют высокоэхогенные стенки и небольшой диаметр – около 1 мм. В некоторых случаях могут наблюдаться те или иные особенности строения и расположения печеночных сосудов, например, добавочные сосуды – дополнительная ветвь печеночной артерии к квадратной доле, хвостатой доле или IV сегменту, своевременное выявление которых может предотвратить некоторые осложнения при проведении операций на печени и желчевыводящей системе. Дифференциация трубчатых структур обычно не представляет существенных сложностей, если учитываются все признаки, включая исследование "на протяжении", т.е. прослеживание дальнейшего хода трубчатой структуры в обоих направлениях. Современные методики цветового и импульсного доплеровского исследования позволяют в подавляющем числе случаев легко дифференцировать эти структуры по наличию цветового сигнала и разности скоростей и направления кровотока в них. Ворота печени являются зоной повышенного интереса для исследователя, поскольку во многих случаях позволяют решить диагностические задачи, учитывая расположение в них крупных сосудов, желче- и лимфоотводящих протоков. Важным моментом исследования является дифференциация выявляемых трубчатых структур – магистрального ствола воротной вены, собственной печеночной артерии, общего печеночного и общего желчного протоков. По оригинальному сравнению, приведенному в поперечном срезе этой области, сделанному в положении косого сканирования, печень имеет вид "головы Микки Мауса", где голова – воротная вена, левое ухо – желчевыводящий проток, а правое ухо – собственная печеночная артерия. Как правило, сложности могут возникнуть при дифференциации протока и артерии, так как они имеют приблизительно одинаковый диаметр, расположение, направление и характер изображения стенок. Для более точной оценки используется исследование "на протяжении", выявление пульсации, применение доплеровских методик (спектральное и цветовое исследования, энергетический доплер). По мнению большинства исследователей, структура паренхимы неизмененной печени представлена мелкозернистым изображением, состоящим из множества мелких точечных и линейных структур, равномерно расположенных по всей площади полученного среза. Иногда вариантом неизмененной паренхимы печени может быть более крупнозернистое изображение при условии сохранения однородности ткани. По эхогенности ткань нормальной печени сопоставима или несколько превышает эхогенность коркового вещества почки (являющегося эталоном при отсутствии патологии этого органа). В ряде случаев в области ворот печени может наблюдаться некоторое повышение эхогенности паренхимы печени. Эхогенность хвостатой доли из-за особенностей ее расположения часто может быть несколько ниже эхогенности левой доли. Причиной, приводящей к некоторому снижению эхогенности хвостатой доли, чаще всего является повышенное поглощение и отражение ультразвука круглой связкой и воротами печени. Еще одним важным признаком считается звукопроводимость органа, которая в норме является хорошей и при исследовании возможна отчетливая визуализация глубоких отделов печени и диафрагмы. Звукопроводимость характеризует отражающую, поглощающую и рассеивающую способности ткани. Чем больше изменений присутствует в ткани (жировых, фиброзных и т.д.), тем хуже ее звукопроводимость и соответственно хуже визуализация глубоко расположенных отделов и структур. Ведя разговор об ультразвуковой анатомии печени, нельзя не отметить возможные анатомические варианты развития, которые в некоторых случаях могут имитировать те или иные патологические состояния. К таковым анатомическим вариантам развития печени относятся: инверсия печени, ротация печени, вариации контуров и размеров долей, доля Риделя, истончение левой доли, врожденное отсутствие левой доли, локальная гипертрофия долей и сегментов печени, дополнительные борозды, интерпозиция толстого кишечника и т.п. Инверсия печени – расположение органа в ином месте брюшной полости – чаще всего в левом подреберье, сочетающееся с инверсией прочих органов пищеварительной системы. Ротация печени – изменение ее расположения вдоль одной из осей – длинной или короткой. Чаще наблюдается вариант ротации по длинной оси, при котором к передней брюшной стенке обращен не нижний край печени, а либо ее висцеральная, либо диафрагмальная поверхности. Вариации контуров и размеров долей являются достаточно частой находкой, однако для их идентификации необходимо сопоставление данных, полученных при эхографии, касающихся не только строения органа, но и его частей, с данными анамнеза и клинико-лабораторноинструментальных исследований. То же самое относится и к остальным вариантам анатомических особенностей печени. Доля Риделя представляет собой врожденную изолированную гипертрофию правой доли печени, при которой может сложиться впечатление о гепатомегалии вследствие патологического процесса, хотя данные эхографии указывают на нормальный характер строения печеночной паренхимы. Дополнительные борозды на поверхностях печени могут привнести лишние сложности, особенно в тех случаях, когда идет речь о травме органа. В этом случае решающее значение имеет оценка контура, капсулы и субкапсулярной паренхимы печени в области предполагаемых изменений. Интерпозиция толстого кишечника связана с таким вариантом расположения поперечно-ободочной кишки и восходящей ободочной кишки, при котором акустический доступ к печени или ее отделам осложнен настолько, что проведение исследования через традиционные доступы является проблематичным. Определенное влияние на качество и характер изображения печени может оказывать наложение изображения прилегающих органов и структур, и патологических процессов в них. Помимо перечисленных имеется ряд других особенностей визуализации и оценки эхографической картины печени, связанных с типом и классом применяемой ультразвуковой диагностической аппаратуры. В первую очередь это особенности, связанные с качеством изображения, глубиной сканирования, разрешающей способностью и др., зависящими от технических параметров приборов. Желчевыводящие пути Общие принципы исследования При проведении исследования желчевыводящей системы целесообразно учитывать приведенные ниже рекомендации последовательного анализа ее состояния для уменьшения возможных диагностических ошибок. 1. Оценка расположения, формы, контуров и анатомического строения желчного пузыря и протоковой системы – сопоставление полученных результатов с имеющимися общими и региональными нормативами с учетом возможных индивидуальных особенностей каждого пациента. 2. Оценка размеров желчного пузыря и протоковой системы – сопоставление полученных результатов с имеющимися общими и региональными нормативами с учетом возможных индивидуальных особенностей каждого пациента. 3. Оценка структуры и эхогенности стенок и полости желчного пузыря – выявление прямых и косвенных признаков опухолевого (доброкачественные и злокачественные) и неопухолевого (острые и хронические воспалительные заболевания, желчекаменная болезнь, вторичные изменения) поражения желчного пузыря. 4. Оценка протоковой системы в целом и конкретных протоков в 5. Оценка влияния окружающих органов и структур на состояние изображения желчевыводящей системы – определение возможного искажения эхографической картины желчевыводящей системы (артефакты). 6. Проведение дифференциальной диагностики выявленных изменений с учетом данных анамнеза, клинических, лабораторных, инструментальных и других методов исследования. 7. Использование данных современных методик исследования для получения дополнительной диагностической информации – при наличии соответствующего технического оснащения – проведение импульсного доплеровского исследования, цветового доплеровского исследования в различных режимах и т.п. 8. Проведение динамического наблюдения за состоянием желчевыводящей системы в необходимых случаях (в частности, в случае отсроченной хирургической помощи и т.п.) – при острых воспалительных поражениях и их осложнениях, при осложнениях желчекаменной болезни, при опухолевых поражениях и т.п. 9. При недостаточной определенности выявленных изменений – проведение динамического наблюдения за пациентом в сроки, адекватные конкретной ситуации, или применение прицельной биопсии для верификации характера поражения. 10. Сопоставление результатов эхографии с методикой и результатами выполнения хирургических вмешательств – при наличии таковых у пациента в ближайшем и отдаленном анамнезе. Поджелудочная железа
История исследования поджелудочной железы уходит в глубину веков. Еще в античные времена было известно, что в брюшной полости есть орган "весь из мяса" (pan-creas). Co времен Галена существенных изменений в знаниях о сущности поджелудочной железы, кроме как особой "подушечки" для желудка, не происходило до середины XVII века, когда Вирсунг обнаружил в поджелудочной железе человека особую протоковую систему, выявленную ранее М. Гоффманом в поджелудочной железе петуха. С тех пор изучение анатомо-физиологических особенностей поджелудочной железы велось крупнейшими учеными всех стран. Однако вплоть до открытия рентгеновского излучения получить ее изображение in vivo не удавалось. Да и, по правде говоря, рентгеновское исследование непосредственно для визуализации поджелудочной железы оказалось столь сложной и небезопасной методикой, что широкого распространения в клинической практике не получило. Радиоизотопная сцинтиграфия, ставшая существенным шагом вперед в вопросах визуализации органа, также не давала полноценной информации о состоянии железы. Существенные успехи рентгеновской компьютерной томографии (КТ) и магнитно-резонансного исследования дали возможность получать в подавляющем большинстве случаев отчетливое изображение поджелудочной железы и патологических процессов в ней, однако высокая стоимость и недостаточная распространенность соответствующей диагностической техники, а также наличие лучевой нагрузки в случае КТ ограничивают широкое распространение этих методик. В настоящее время именно ультразвуковой метод исследования в режиме реального масштаба времени, претерпевающий ныне бурное развитие, пожалуй, впервые за всю историю позволил поставить визуализацию поджелудочной железы в ряд относительно сложных, но все же безопасных и рутинных исследований. Поджелудочная железа располагается в надчревной области и левом подреберье. Направление длинной оси железы имеет некоторый угол по отношению к поперечной плоскости, ввиду чего головка обычно располагается ниже хвостовой части (рис. 11, 12). В поджелудочной железе различают три отдела (головку, тело и хвост) и три поверхности (переднюю, нижнюю и заднюю). Иногда место перехода головки в тело имеет небольшую впадину, носящую название перешейка (либо шейки или перемычки). Форма поджелудочной железы также может быть разнообразной – с равномерной толщиной всех отделов или с преимущественным относитель-
ным увеличением какого-либо одного или двух отделов. Рис. 11. Схематическое изображение нормальной анатомии и топографии поджелудочной железы: 1 – селезеночная артерия; 2– главный панкреатический проток
При ультразвуковом исследовании поджелудочная железа выявляется в эпигастральной области кпереди от магистральных сосудов (нижняя полая вена (НПВ), аорта) и позвоночного столба. Маркерами расположения и границ поджелудочной железы являются прежде всего сосуды брюшной полости – НПВ, аорта, верхние брыжеечные вена и артерия, располагающиеся ниже тела железы, чревный ствол и его ветви, лежащие краниальнее, селезеночные сосуды, проходящие по задненижней поверхности хвоста, и гастродуоденальная артерия (рис. 13). Нижняя полая вена в положении поперечного и косого сканирования имеет вид эллипсоидной структуры с коротким переднезадним диаметром и выявляется сразу сзади от изображения головки поджелудочной железы. При продольном сканировании вдоль головки железы нижняя полая вена имеет вид трубчатой структуры с тонкими гиперэхогенными стенками, выявляемой в том же месте – вдоль задней поверхности головки. В редких случаях в некоторых срезах между головкой железы и нижней полой веной можно выявить еще одну трубчатую структу-
почечную артерию, которая также прилежит к задней поверхности железы. Рис. 13. Схематическое изображение расположения некоторых сосудистых маркеров поджелудочной железы при косом сканировании. ВБВ – верхняя брыже-
В большинстве же наблюдений эта артерия проходит позади нижней полой вены. В области передней поверхности головки обычно отчетливо выявляется гастродуоденальная артерия, являющаяся ветвью общей печеночной артерии и кровоснабжающая, в частности, головку, шейку, часть тела поджелудочной железы и 12-перстную кишку. В области шейки поджелудочной железы отчетливо определяется место слияния верхней брыжеечной вены и селезеночной вены, подходящих обычно с взаимно противоположных направлений, и формируется магистральный ствол воротной вены, направляющийся далее к воротам печени. В области тела железы также определяется несколько крупных артериальных и венозных сосудов. Краниальнее тела располагается чревный ствол, визуализируемый в положении ко
|
||||||||||
|
Последнее изменение этой страницы: 2016-06-06; просмотров: 323; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.223.129 (0.017 с.) |

 Изображение печени, получаемое при ультразвуковом исследовании, состоит из множества томографических срезов, имеющих небольшую толщину, что не позволяет получить визуальное отображение формы всего органа в целом. Поэтому исследователю приходится проводить мысленную реконструкцию формы органа. Однако в каждом из срезов имеется возможность проанализировать контуры поверхностей и сопоставить их с анатомическими вариантами. Образно говоря, форму изображения печени при продольном срезе через все доли в положении косого сканирования можно сравнить с большой, горизонтально расположенной запятой. Поперечный срез правой доли печени в положении продольного сканирования чаще напоминает "состарившийся" полумесяц, а форма левой доли при тех же условиях имеет вид Г-образ-
Изображение печени, получаемое при ультразвуковом исследовании, состоит из множества томографических срезов, имеющих небольшую толщину, что не позволяет получить визуальное отображение формы всего органа в целом. Поэтому исследователю приходится проводить мысленную реконструкцию формы органа. Однако в каждом из срезов имеется возможность проанализировать контуры поверхностей и сопоставить их с анатомическими вариантами. Образно говоря, форму изображения печени при продольном срезе через все доли в положении косого сканирования можно сравнить с большой, горизонтально расположенной запятой. Поперечный срез правой доли печени в положении продольного сканирования чаще напоминает "состарившийся" полумесяц, а форма левой доли при тех же условиях имеет вид Г-образ- Причем при достаточно больших размерах хвостатый отросток может значительно выступать со стороны висцеральной поверхности печени
Причем при достаточно больших размерах хвостатый отросток может значительно выступать со стороны висцеральной поверхности печени 

 В головке поджелудочной железы выделяют крючковидный отросток, который располагается с медиальной стороны и заходит под верхнюю брыжеечную вену. Размеры отростка могут быть вариабельны – от практически полного отсутствия отростка до размера, сопоставимого с толщиной тела железы. Часто именно увеличение отростка приводит к сдавливанию верхней брыжеечной вены и иногда одноименной артерии. В ткани железы располагается протоковая система, состоящая из главного панкреатического протока и его множественных мелких ветвей. Главный панкреатический проток формируется в области хвоста и идет в направлении головки по всей длине железы. В головке, сделав поворот назад и вниз в направлении общего желчного протока, панкреатический проток открывается в ampulla Vateri. У 75 – 80 % людей помимо главного имеется и дополнительный панкреатический проток, в 90 % случаев впадающий в главный, а в остальных – самостоятельно открывающийся в 12-перстную кишку. Внутренняя структура ткани железы представлена дольками ацинарного типа, образованными эпителиально-железистой тканью и островковыми элементами, разделенными прослойками соединительной ткани, отходящей от слабо выраженной собственной капсулы железы, представленной "мягкой" соединительной тканью. Каждая из долек имеет выводной проток, соединяющийся с главным панкреатическим протоком. Особенностью топографии является тесное взаимоотношение железы с многими сосудами и органами брюшной полости и забрюшинного пространства (см. рис. 11). Так, головка поджелудочной железы охвачена и частично прикрыта спереди петлей двенадцатиперстной кишки и соприкасается с толстой кишкой, печенью, нижней полой веной, аортой, общим желчным протоком, воротной веной и мелкими артериями, а также иногда с желчным пузырем. Тело соприкасается с задней стенкой желудка, поперечно-ободочной кишкой, тощей кишкой, брыжеечными и селезеночными сосудами, аортой, малым сальником и иногда с левой почкой и надпочечником. Хвост, располагаясь в глубине левого подреберья, соприкасается с селезенкой (область ворот и внутренней поверхности), сводом желудка, медиальной частью левой почки, селезеночными сосудами и левым надпочечником.
В головке поджелудочной железы выделяют крючковидный отросток, который располагается с медиальной стороны и заходит под верхнюю брыжеечную вену. Размеры отростка могут быть вариабельны – от практически полного отсутствия отростка до размера, сопоставимого с толщиной тела железы. Часто именно увеличение отростка приводит к сдавливанию верхней брыжеечной вены и иногда одноименной артерии. В ткани железы располагается протоковая система, состоящая из главного панкреатического протока и его множественных мелких ветвей. Главный панкреатический проток формируется в области хвоста и идет в направлении головки по всей длине железы. В головке, сделав поворот назад и вниз в направлении общего желчного протока, панкреатический проток открывается в ampulla Vateri. У 75 – 80 % людей помимо главного имеется и дополнительный панкреатический проток, в 90 % случаев впадающий в главный, а в остальных – самостоятельно открывающийся в 12-перстную кишку. Внутренняя структура ткани железы представлена дольками ацинарного типа, образованными эпителиально-железистой тканью и островковыми элементами, разделенными прослойками соединительной ткани, отходящей от слабо выраженной собственной капсулы железы, представленной "мягкой" соединительной тканью. Каждая из долек имеет выводной проток, соединяющийся с главным панкреатическим протоком. Особенностью топографии является тесное взаимоотношение железы с многими сосудами и органами брюшной полости и забрюшинного пространства (см. рис. 11). Так, головка поджелудочной железы охвачена и частично прикрыта спереди петлей двенадцатиперстной кишки и соприкасается с толстой кишкой, печенью, нижней полой веной, аортой, общим желчным протоком, воротной веной и мелкими артериями, а также иногда с желчным пузырем. Тело соприкасается с задней стенкой желудка, поперечно-ободочной кишкой, тощей кишкой, брыжеечными и селезеночными сосудами, аортой, малым сальником и иногда с левой почкой и надпочечником. Хвост, располагаясь в глубине левого подреберья, соприкасается с селезенкой (область ворот и внутренней поверхности), сводом желудка, медиальной частью левой почки, селезеночными сосудами и левым надпочечником.



