
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фгбоу во ставропольский государственныйСодержание книги Поиск на нашем сайте
ФГБОУ ВО СТАВРОПОЛЬСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
НЕОРГАНИЧЕСКАЯ ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЯ ДЛЯ ВЫПОЛНЕНИЯ КОНТРОЛЬНОЙ РАБОТЫ СТУДЕНТАМ ЗАОЧНОЙ И ЗАОЧНОЙ СОКРАЩЕННОЙ ФОРМ ОБУЧЕНИЯ по направлениям подготовки: 35.03.01 Ветеринарно-санитарная экспертиза 111100.62 Зоотехния 35.03.07 Технология производства и переработки с.-х. продукции
Ставрополь 2015 г. УДК 54(075.4) Печатается по решению методической комиссии факультета защиты растений ББК 24 и методического совета ФГБОУ ВПО Х - 462 «Ставропольский государственный аграрный университет» (протокол № 10 от 10.122015 г.).
Рецензенты: химических наук. профессор И.В.Боровлев доцент С.В.Окрут
Составители: доцент Ю.А. Безгина доцент Е.В. Волосова доцент Е.В. Пашкова, доцент А.Н. Шипуля,
Неорганическая химия: методические указания по изучению дисциплины и задания для выполнения контрольной работы студентам заочной формы обучения Ставрополь: СтГАУ, 2015.– 67 с.
Раздел 1. ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ ВВЕДЕНИЕ Цель и задачи курса неорганической химии Курс неорганической химии включает в себя материал, необходимый для подготовки специалистов сельскохозяйственного производства. Студент-заочник должен хорошо подготовиться к успешному усвоению специальных дисциплин, основывающихся на курсе химии или в той или иной мере использующих химический материал. Дисциплина «Неорганическая химия» закладывает основы научного мировоззрения, служит фундаментом общетехнической эрудиции, формирует «технический язык» будущего специалиста. В результате усвоения материала общетеоретической части студент-заочник должен приобрести тот минимальный запас знаний, который необходим для восприятия важных сведений по специальной части курса на современном научном уровне. В специальной части курса на основе очень кратких сведений по химии отдельных элементов изучаются необходимые данные о веществах и процессах, важных для сельскохозяйственного производства, причем основное внимание обращается на химическую сторону явлений. Таким образом, основные задачи курса химии следующие:
– изучение основ современной химии; – выработка умений, приемов экспериментальной работы и качеств, необходимых для специалиста высшей категории; – освоение общих приемов овладения новыми знаниями (умения работать с литературой; развитие творческого мышления; представление об экспериментальных исследованиях и способах обработки полученных данных).
Выполнение контрольной работы При самостоятельном изучении курса необходимо ознакомиться с требованием программы по химии. В соответствии с учебным планом каждый студент должен выполнить одну контрольную работу, являющуюся результатом самостоятельной проработки курса. Это служит основанием для его вызова на лабораторно-экзаменационную сессию. Во время сессии после прослушивания лекций и выполнения лабораторных работ студент сдает зачет (экзамен) по всему курсу. Контрольную работу нужно писать аккуратно, разборчиво. Для замечания рецензента необходимо оставлять поля. Условие задачи необходимо переписать полностью и указывать номера задач в соответствии с контрольным заданием. Ход решения задач и все расчеты должны быть доведены до конца. В конце работы указывается использованная литература, ставится подпись и дата выполнения работы. Неряшливо или не полностью выполненная контрольная работа будет возвращена студенту. Получив рецензию, студент должен внимательно ознакомиться со всеми замечаниями и указаниями преподавателя. Доработку неправильно выполненных задач необходимо проделать в конце тетради. На зачете (экзамене) по химии будет проводиться собеседование по материалу контрольной работы. Данные методические указания, примеры, упражнения и контрольные задания имеют цель восстановить или закрепить основы, необходимые для усвоения курса химии в целом. Они требуют активной проработки и ими следует пользоваться параллельно с рекомендованными учебниками. Целесообразно завести специальную тетрадь, выполнять в ней предлагаемые упражнения, записывать невыясненные вопросы. После изучения очередной темы или раздела следует сразу приступить к выполнению соответствующего контрольного задания. Библиографический список а) основной:
б) дополнительный:
в) программное обеспечение и Интернет-ресурсы:
Раздел 2. ВОССТАНОВИТЕЛЬНАЯ ЧАСТЬ
Химическая символика Любой химический символ имеет двойной смысл: 1) обозначает атом или молекулу; 2) обозначает атомную или молекулярную массу. Поэтому из химической формулы и из химического уравнения вытекает два вывода: качественный и количественный. В химии принято атом (химический элемент) обозначать химическим знаком, молекулу – химической формулой, схему химического превращения одних веществ в другие – уравнениями химических реакций. Химический знак – обозначают первыми (одной или двумя) буквами латинского названия элемента. Пример: Н – Hydrogenium – водород, N – Nytrogenium – азот, Аu – Aurum – золото. Известно 109 химических элементов. Каждый элемент имеет знак и место в таблице – «клетку». «Клетка» имеет свой номер и, кроме того, соответствует определенному номеру вертикального столбца – группы и номеру горизонтального ряда – периода (начиная с четвертого, каждый период делится на два ряда, каждая группа делится на две подгруппы – главную и побочную. Главная подгруппа более длинная по вертикали, в нее входят элементы всех периодов; а побочная короткая, в ней элементы только 4-7 периодов). Упражнение. Пользуясь таблицей Д.И.Менделеева, найдите символы кислорода, молибдена, железа, хрома. Приведите русские названия следующих элементов: Сu, Cl, Mg, К, Са. Укажите номера их периода и группы, подгруппу (главная или побочная). В каждой «клетке» приведены порядковый номер элемента и атомная масса элемента,выраженная в а.е.м. Что это такое? Пример. Какой элемент находится в третьем периоде четвертой группы? Это углерод: С; атомный номер 6; атомная масса 12 а.е.м.; его «клетка» расположена на пересечении 2 горизонтального ряда и IV вертикального столбца. Упражнение. Укажите латинское и русское названия, химический знак, порядковый номер и атомную массу элементов третьего периода третьей группы; третьего периода шестой группы; четвертого периода шестой группы побочной подгруппы; четвертого периода пятой группы в главной и побочной подгруппах. Химическая формула – отражает качественный состав вещества – химическими знаками входящих в него элементов, и количественный – с помощью подстрочных индексов. Подстрочный индекс указывает количество атомов этого элемента в молекуле, а коэффициент перед формулой «сообщает» о количестве молекул данного вещества. Пример. Выражение 3Ca(NO3)2 означает, что здесь 3 молекулы Ca(NO3)2. В одной молекуле: один атом кальция, два атома азота, 6 атомов кислорода. В трех молекулах количество атомов каждого элемента утроено.
Упражнение. Дано 8Na3PO4. Приведите латинские и русские названия элементов. Сколько атомов каждого элемента в молекуле? Сколько здесь всего молекул? Сколько всего атомов? Какова молекулярная масса этого вещества? Уравнение химической реакции – краткая схематическая запись химического процесса – дает: а) качественную информацию о том, какие исходные веществаучаствуют в реакции и какие продукты(конечные вещества) получаются в результате этой реакции; б) количественную информацию о том, сколько молекул исходных веществ и продуктов участвуют в реакции. Это следует из значений коэффициентов – индексов перед формулами реагирующих веществ. Пример: 2СО + О2 = 2СО2. исходные продукты вещества Это значит: из двух молекул СО и одной молекулы О2 получается 2 молекулы СО2. Упражнение. Дано уравнение химической реакции: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O Приведите латинские и русские названия элементов. Укажите простые и сложные вещества. Сколько молекул каждого вещества участвуют в одной реакции? Какова масса всех продуктов реакции в атомных единицах массы? Соответствует ли она массе исходных веществ? Раздел 3. ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
Некоторых веществ
Пример 1. При взаимодействии кристаллов хлорида фосфора (V)с парами воды образуется жидкий РОСl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции. Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Q p, равные изменению энтальпии системы ∆ H. Значение ∆ H приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния веществ: г – газообразное, ж – жидкое, к – кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно. Если врезультате реакции выделяется теплота, то ∆ H < 0. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции: РСl5 (к) + Н2O (г) = РОСl3 (ж) + 2НСl (г); ∆ H х.р. = –111,4 кДж. Пример 2. Реакция горения этана выражается термохимическим уравнением: С2Н6 (г) + 31/2О2 = 2СО2 (г) + 3Н2O (ж) ∆ H х.р. = – 1559,87 кДж. Вычислите теплоту образования этана, если известны теплоты образования СО2 (г) и Н2О (ж) (табл. 3). Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т. е. 25°С (298°К) и 1,013·105 Па, и обозначают через ∆Н °298. Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ∆ H. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид:
2С (графит) + 3Н2 (г) = С2Н6 (г); ∆ H =? исходя из следующих данных: а) С2Н6 (г) + 31/2О2 (г) = 2СО2 (г) + 3Н2О (ж) ∆ H = –1559,87 кДж; б) С (графит) + О2 (г) = СО2 (г); ∆ H = –393,51 кДж; в) Н2 (г) + 1/2О2 = Н2О (ж); ∆ H = –285,84 кДж. На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а затем сумму этих уравнений вычесть из уравнения (а): C2H6 + 31/2O2 – 2C – 2О2 – 3Н2 – 3/2О2 = 2СО2 + 3Н2О – 2СО2 – 3Н2О ∆ H = –1559,87 – 2(–393,51) –3(–285,84) = +84,67 кДж ∆ H = –1559,87+787,02+857,52; С2Н6 = 2С + 3Н2 ∆ H = +84,67 кДж. Так как теплота образования равна теплоте разложения с обратным знаком, то ∆ H обр.С2Н6 (г) = – 84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса: ∆ H х.р. = 2∆ H СО2 + 3∆ H Н2О – ∆ H С2Н6 – ∆ H О2 Учитываем, что теплоты образования простых веществ условно приняты равными нулю: ∆ H С2Н6 = 2∆ H СО2 + 3∆ H Н2О – ∆ H х.р. ∆ H С2Н6 = 2(–393,51) +3(–285,84) + 1559,87 = – 84,67; ∆ H обр.С2Н6 (г) = – 84,67 кДж Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением: С2Н5ОН (ж) + 3О2 (г) = 2СО2 (г) + 3Н2О (ж); ∆ H =? Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН (ж) равна + 42,36 кДж и известны теплоты образования: С2Н5ОН (г), СО2 (г), Н2О (ж) (см. табл. 3). Решение. Для определения ∆ H реакции необходимо знать теплоту образования С2Н5ОН (ж). Последнюю находим из данных: С2Н5ОН (ж) = С2Н5ОН (г); ∆ H = + 42,36 кДж. +42,36 = – 235,31 – ∆ H С2Н5ОН (ж) ∆ H С2Н5ОН (ж) = –235,31 – 42,36 = –277,67 кДж. Вычисляем ∆ H реакции, применяя следствия из закона Гесса: ∆ H х.р. = 2(–393,51) + 3(–285,84) + 277,67 = –1366,87 кДж.
Контрольные вопросы 21. Вычислите, какое количество теплоты выделится при восстановлении Fе2О3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж. 22. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: – 45,76 кДж. 23. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO (к) + СО (г) = Fe (к) + СО2 (г); ∆ H = – 13,18 кДж. СО (г) + 1/2О2 (г) = СО2 (г); ∆ H = – 283,0 кДж. Н2 (г) + 1/2О2 (г) = Н2О (г); ∆ H = – 241,83 кДж. Ответ: + 27,99 кДж. 24. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2 (г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: + 65,43 кДж. 25. Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж. 26. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO исходя из следующих термохимических уравнений: 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (ж); ∆ H = – 1168,80 кДж. 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6H2О (ж); ∆ H = 1530,28 кДж. Ответ: 90,37 кДж. 27. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж. 28. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана исходя из следующих термохимических уравнений: Н2 (г) + 1/2О2 (г) = Н2О (ж); ∆ H = – 285,84 кДж. С (к) + О2 (г) = СО2 (г); ∆ H = – 393,51 кДж. СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); ∆ H = – 890,31 кДж. Ответ: – 74,88 кДж. 29. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция исходя из следующих термохимических уравнений: Са (к) + 1/2О2 (г) = СаО (к); ∆ H = – 635,60 кДж. Н2 (г)+ 1/2О2 (г) = Н2О (ж); ∆ H = – 285,84 кДж. СаО (к) + Н2О (ж) = Са(ОН)2 (к); ∆ H = – 65,06 кДж. Ответ: – 986,50 кДж. 30. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен – 3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: + 49,03 кДж. 31. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж. 32. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж. 33. Реакция горения метилового спирта выражается термохимическим уравнением: СН3ОН (ж) + 3/2О2 (г) = 2Н2О (ж) + СО2 (г); ∆ H =? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: – 726,62 кДж. 34. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН (ж). Ответ: – 277,67 кДж/моль. 35. Реакция горения бензола выражается термохимическим уравнением С6Н6 (ж) + 71/2О2 (г) = 6СО2 (г) + 3Н2О (г); ∆ H =? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж. Ответ: – 3135,58 кДж. 36. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6 (г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж. 37. Реакция горения аммиака выражается термохимическим уравнением: 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж); ∆ H = –1530,28 кДж. Вычислите теплоту образования NH3 (г). Ответ: – 46,19 кДж/ моль. 38. При взаимодействии 6,3 г железа с серой выделилось 11,31кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: – 100,26 кДж/моль. 39. При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н2(г). Ответ: 226,75 кДж/моль. 40. При получении эквивалентной массы гидроксида кальция из СаО (к) и Н2О (ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Химическое сродство При решении задач этого раздела см. табл. 3 – 5. Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты. Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н;сдругой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая – с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией. Энтропия S, так же, как внутренняя энергия U,энтальпия H, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т. е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, ослаблении при разрыве связей между атомами и т. п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. п., – ведут к уменьшению энтропии. Энтропия является функцией состояния, т. е. ее изменение (∆ S) зависит только от начального (S 1) иконечного (S 2) состояния и не зависит от пути процесса: ∆ S х.р. = S S °прод.– S S °исх. (2) ∆ S = S 2– S 1, если S 2> S 1, то ∆ S >О; если S 2 < S 1, то ∆ S < 0 Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка ≈ Т ∆ S. Энтропия выражается в Дж/(моль·К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS), При p =const и Т = const общую движущую силу процесса, которую обозначают ∆ G, можно найти из соотношения: ∆ G = (Н 2 – Н 1) – (S 2 – S 1); ∆ G = ∆ Н – Т ∆ S. Величина G называется изобарно-изотермическим потенциалом, или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (∆ G), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому: ∆ G х.р. = S G °прод.– S G °исх. (3) Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения: ∆ G. Если ∆ G< 0, процесс принципиально осуществим; если ∆ G >0, процесс самопроизвольно проходить не может. Чем меньше ∆ G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором ∆ G = 0 и ∆ H = T ∆ S. Из соотношения ∆ G = ∆ H – Т ∆ S видно, что самопроизвольно могут протекать и процессы, для которых ∆ H >0 (эндотермические). Это возможно, когда ∆ S >0, но | T ∆ S | >|∆ H |, и тогда ∆ G < 0. С другой стороны, экзотермические реакции (∆ H < 0) самопроизвольно не протекают, если при ∆ S < 0 окажется, что ∆ G >0.
Таблица 4 Стандартная энергия Гиббса образования ∆ G °298 Некоторых веществ
Пример 1. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре? Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре. Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4 (г) + СО2 (г) ↔ 2CO (г) + 2Н2 (г) Решение. Для ответа на вопрос следует вычислить ∆ G °298 прямой реакции. Значения ∆ G °298 соответствующих веществ приведены в табл.4. Зная, что ∆ G есть функция состояния и что ∆ G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ∆ G °298 процесса: ∆ G °298 = 2(–137,27) + 2(0) – (–50,79 –394,38) = + 170,63 кДж. То что ∆ G °298 >0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298°К и равенстве давлений взятых газов 1,013·105 Па (760 мм рт. ст. = 1 атм). Таблица 5 Стандартные абсолютные энтропии S°298 некоторых веществ
Пример 3. На основании стандартных теплот образования (табл.3) и абсолютных стандартных энтропии веществ (табл.5) вычислите ∆ G °298 реакции, протекающей по уравнению: СО (г) + Н2О (ж) = СО2 (г) + Н2 (г) Решение. ∆ G ° = ∆ H° – Т ∆ S °; ∆ H и ∆ S – функции состояния, поэтому: ∆ H° х.р. = S∆ H° обр.прод.– S∆ H° обр.исх.; ∆ S° х.р. = S S° обр.прод. – S S° обр.исх ∆ H° х.р. = (– 393,51+0) – (–110,52 – 285,84) = +2,85 кДж; ∆ S° х.р.= (213,65+130,59)–(197,91+69,94)=+76,39=0,07639 кДж/(моль·К); ∆ G ° = + 2,85 – 2980,07639 = – 19,91 кДж. Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению: Fе2O3 (к) + 3Н2 (г) = 2Fе (к) + 3Н2O (г); ∆ H = + 96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии ∆ S = 0,1387 кДж/(моль·К)? При какой температуре начнется восстановление Fe2O3? Решение. Вычисляем ∆ G ° реакции: ∆ G = ∆ H – Т ∆ S = 96,61 – 298 · 0,1387 = +55,28 кДж. Так как ∆ G >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ∆ G = 0:
Следовательно, при температуре ≈ 696,5°К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции. Пример 5. Вычислите ∆ H °, ∆ S ° и ∆ G °т реакции, протекающей по уравнению Fe2O3 (к) + 3С = 2Fе + 3СО. Возможна ли реакция восстановления Fe2O3 углеродом при температуре, 500 или 1000°К? Решение. ∆ H° х.р.=[3(–110,52+2·0]–[–882,10 +3·0]= –331,56–882,10=+490,54 кДж; ∆ S° х.р. = (2/27,2 + 3·197,91) – (89,96 + 3·5,69) = 541,1 Дж/К. Энергию Гиббса при соответствующих температурах находим из соотношения ∆ G °т = ∆ H ° – Т ∆ S: ∆ G 500 = 490,54 – 500 ∆ G 1000 = 490,54 – 1000 Так как ∆ G 500 >0, a ∆ G 1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000°К и невозможно при 500°К. Контрольные вопросы 41. Вычислите ∆ G 0298 для следующих реакций: a) 2NaF (к) + Cl2 (г) = 2NaCl (к) + F2 (г) б) PbO2 (к) + 2Zn (к).= Pb (к) + 2ZnO (к). Можно ли получить фтор по реакции (а) и восстановить РbО2 цинком по реакции (б)? Ответ: +313,94 кДж; – 417,4 кДж. 42. При какой температуре наступит равновесие системы: 4НСl (г) + О2 (г) ↔ 2Н2О (г) + 2Сl2 (г); ∆ H = – 114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891°К. 43. Восстановление Fе3О4 оксидом углерода идет по уравнению: Fe3O4 (к) +СО (г) = 3FeO (к) + СО2 (г) Вычислите ∆ G °298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ∆ S° 298 в этом процессе? Ответ: +24,19 кДж; + 31,34 Дж/(моль·К). 44. Реакция горения ацетилена идет по уравнению: С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж) Вычислите ∆ G °298 и ∆ S° 298. Объясните уменьшение энтропии в результате этой реакции. Ответ: – 1235,15 кДж; – 216,15 Дж/(моль·К). 45. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите ∆ S° 298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж/(моль·К); б) – 3,25 Дж/(моль·К). 46. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция: Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); ∆ H = – 2,85 кДж? Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆ G °298 этой реакции. Ответ: + 19,91 кДж. 47. Прямая или обратная реакция будет протекать при стандартных условиях в системе: 2NO (г) + O2 (г) ↔ 2NO2 (г) Ответ мотивируйте, вычислив ∆ G °298 прямой реакции. Ответ: – 69,70 кДж. 48. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ, вычислите ∆ G °298 реакции, протекающей по уравнению:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 195; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.19 (0.013 с.) |


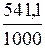 = + 219,99 кДж;
= + 219,99 кДж;


