
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и свойства биологических мембранСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте Студент должен знать: структурные основы функционирования мембран, строение, свойства и функции биологических мембран; определения жидкокристаллического и твердокристаллического состояний и условия фазового перехода между ними; физические свойства мембраны как фазы; понятия латеральная диффузия и “флип-флоп” переходов [1-4, 6].
Контрольные вопросы 1. Толщина биологических мембран составляет порядка: а) 0,01 нм; б) 0,1 нм; в) 10 нм; г) 100 нм; д) 1 мкм. 2. Строение биологической мембраны. 3. Липиды в составе биологических мембран находятся: а) в твердом аморфном состоянии; б) в твердокристаллическом состоянии; в) в жидком аморфном состоянии; г) жидкокристаллическом состоянии; д) правильный ответ не приведен. 4. При фазовом переходе мембран из жидкокристаллического в гель-состояние (твердокристаллическое) площадь мембраны, приходящаяся на одну молекулу липида: а) уменьшается; б) увеличивается; в) не изменяется. 5. При фазовом переходе мембран из жидкокристаллического в твердо-кристаллическое состояние толщина мембраны: а) уменьшается; б) увеличивается; в) не изменяется. 6. Чем больше в жирнокислотных неполярных «хвостах» липидов двойных связей, тем температура фазового перехода: а) выше; б) ниже; в) не зависит от этого. 7. Температура плавления мембраны связана с изменением энтальпии и энтропии в этом процессе следующим образом: а) Т пл = г) Т пл = 8. От каких параметров зависит скорость латеральной диффузии молекул в мембране. 9. Температура плавления мембраны или температура фазового перехода соответствует температуре, при которой а) все фосфолипиды находятся в жидкокристаллическом состоянии; б) все фосфолипиды находятся в твердокристаллическом состоянии; в) количество фосфолипидов, находящихся в твердокристаллическом состоянии, равно количеству фосфолипидов в жидкокристаллическом состоянии; г) 90% фосфолипидов находятся в жидкокристаллическом состоянии. 10. Холестерин встраивается в фосфолипидный бислой клеточной мембраны, при этом: а) вязкость этого слоя уменьшается, проницаемость мембраны увеличивается; б) вязкость не изменится, проницаемость не изменится; в) вязкость увеличивается, проницаемость мембраны уменьшается; г) вязкость увеличивается, проницаемость уменьшается. 11. При некоторых патологических процессах (отек легкого) утолщаются тканевые мембраны, но разность концентраций веществ по обе стороны мембраны остается неизменной. При этом транспорт веществ в организме: а) замедляется; б) усиливается; в) не изменяется; г) становится равным нулю. 12. Липидные модели биологических мембран: ___(1), ___(2), ___(3). 13. Классифицировать по типам (1 – общие, 2 – специфические) перечисленные функции биомембран: а) транспортная, б) барьерная, в) генерация биопотенциала; г) рецепторная.
Примеры решения задач 1. Рассчитайте толщину d мембраны, если ее участок площадью S =1мкм2 имеет электрическую емкость, равную C =0,3·10-14 Ф. Решение. Из формулы для емкости электрического конденсатора
2. Рассчитайте коэффициент D латеральной диффузии фосфолипидов, если среднее время их оседлой жизни составляет τ=5·10-8 с. Площадь, занимаемая одной молекулой на мембране, составляет A =5,5·10-19 м2. Решение. Время оседлой жизни молекулы обратно пропорционально частоте перескоков молекул на мембране вследствие латеральной диффузии
откуда получаем
Задачи для самостоятельного решения 1. Рассчитайте диэлектрическую проницаемость ε мембранных липидов, если толщина мембраны d =10 нм, удельная электрическая емкость C =1,7·10-3 Ф/м2. 2. Рассчитайте время τ оседлой жизни и частоту перескоков ν из одного мембранного слоя в другой липидов мембран саркоплазматического ретикулума, если коэффициент латеральной диффузии D =12 мкм2/c, площадь, занимаемая одной молекулой фосфолипида, - А =0,7 нм2. 3. Рассчитайте среднее квадратичное перемещение S ср.кв. молекул белков за 1 с, если коэффициент латеральной диффузии для них составляет приблизительно D =10-14 м2/c. 4. Олеиновая кислота СН3(СН2)7СН=СН(СН2)7СООН массой m =7,3 мкг образует на поверхности воды монослойную пленку круглой формы диаметром d =7,3 см. Вычислите площадь А, которую занимает одна молекула олеиновой кислоты. 5. Сколько молекул фосфолипида находится в липосоме диаметром d =40 нм, если площадь, занимаемая одной молекулой равна А =0,6 нм2. Площади внутреннего и внешнего слоев приблизительно равны, плотность упаковки фосфолипидов постоянна. 6. Рассчитайте температуру t пл фазового перехода жирной кислоты, если во время плавления энтальпия изменяется на Δ H =15 кДж/моль, а энтропия - на Δ S =52 Дж/(К·моль). 7. Одна молекула фосфолипида занимает площадь 0,7 нм2. Сколько молекул фосфолипидов содержится в 1мкм2 фосфолипидной бислойной мембраны? 8. Определите диэлектрическую проницаемость биологической мембраны толщиной 7,5 нм, если ёмкость единицы площади мембраны равна 1 мкФ/см2. 9. Вычислите толщину мембраны, если средняя электрическая ёмкость единицы площади мембраны равна 1 мкФ/см2. Диэлектрическая проницаемость биомембраны равна 9.
Свойства электролитов Студент должен знать: элементы физической химии, основы теории Дебая-Хюккеля о равновесных свойствах электролитов; понятия ионной силы раствора, радиуса экранирования заряда, особенности взаимодействия макромолекул в растворах электролитов; основы теории Гуи-Чепмена двойного электрического слоя; методику оценки поверхностной плотности заряда; электрокинетические явления и соотношения между ними, понятие дзета-потенциала и его косвенную оценку по формуле Смолуховского [3, 8].
Контрольные вопросы 1. Ионная сила раствора электролита определяется следующим образом: а) г) 2. Толщина ионной оболочки, окружающей в электролите заряженную макромолекулу, зависит а) только от свойств электролита; б) от температуры и размера макромолекулы; в) от свойств электролита при определенной температуре; г) от температуры и ионной силы раствора; д) от заряда макромолекулы и ионной силы раствора. 3. Объемная плотность заряда ионной атмосферы зависит а) только от кулоновского поля центрального иона; б) только от теплового движения; в) только от свойств электролита; г) от кулоновского поля центрального иона и теплового движения; д) от кулоновского поля центрального иона, тепловых флуктуаций и свойств электролита; е) от кулоновского поля центрального иона и свойств электролита; 4. Параметра Дебая-Хюккеля χ а) определяет расстояние 1/χ, на котором происходит падение потенциала электрического поля центрального иона в е раз; б) определяет расстояние 1/χ, на котором происходит падение потенциала электрического поля центрального иона в 2 раза; в) определяет расстояние χ, на котором происходит падение потенциала электрического поля центрального иона на порядок; г) определяет расстояние χ, на котором происходит падение потенциала электрического поля центрального иона в е раз; д) правильный ответ не приведен. 5. При разбавлении солевого раствора параметр Дебая-Хюккеля а) увеличивается; б) не изменяется; в) уменьшается. 6. Белок осаждается в растворе а) при уменьшении концентрации соли; б) при высокой ионной силе раствора; в) при низкой ионной силе раствора; г) при увеличении концентрации соли. 7. При увеличении ионной силы раствора толщина ионной оболочки а) уменьшается; б) увеличивается; в) не изменяется. 8. Перечислите и охарактеризуйте электрокинетические явления. 9. Размер диффузионной области двойного слоя зарядов а) тождествен параметру Дебая-Хюккеля; б) определяется как расстояние, на котором потенциал электрического поля поверхностного заряда уменьшается в е раз; в) определяется как расстояние, на котором потенциал электрического поля поверхностного заряда уменьшается на порядок; г) равен величине, обратной параметру Дебая-Хюккеля; д) определяется только величиной поверхностного заряда. 10. Распределение ионов в области заряженной поверхности определяется: а) поверхностным зарядом; б) тепловыми флуктуациями и свойствами электролита; в) электростатическим притяжением; г) электрическим полем поверхностного заряда, тепловыми флуктуациями и свойствами электролита; д) электрическим притяжением и тепловыми флуктуациями.
Примеры решения задач 1. Пусть имеется так называемый фосфатный буфер, включающий 0,1 моль/л KH2PO4 и 0,05 моль/л K2HPO4. Оценить ионную силу раствора и дебаевский радиус экранирования заряда (эффективную толщину ионной оболочки) при температуре t =38oC; принять для воды ε=74. Решение. Рассчитываем концентрации отдельных ионов: [ K +] = [ KH2PO4 ] + 2[ K2HPO4 ] = 0,2 М (обозначение М эквивалентно размерности моль/л); [ H2PO4 -] = 0,1 М; [ HPO4 2-] = 0,05 М. Ионная сила раствора:
Дебаевский радиус r D – величина, обратная параметру Дебая-Хюккеля χ:
/(2·6,02·10231/моль·(1,6·10-19) 2Кл2·0,25·103моль/м3)] 1/2 м = 6·10-10 м.
2. Определите, во сколько раз отличаются ионные силы растворов двух солей, KCl и CaCl 2 и радиусы экранирования зарядов в этих растворах, если концентрации растворов одинаковы, их диэлектрические проницаемости близки, и температуры одинаковы. Решение. Обозначим исходные концентрации солей в растворах как С. Ионная сила раствора соли KCl:
Ионная сила раствора соли CaCl 2:
Ионные силы растворов отличаются в три раза: Отношение радиусов экранирования зарядов в растворах:
При одинаковых концентрациях ионная сила раствора соли CaCl 2 в 3 раза больше, а дебаевский радиус в
Задачи для самостоятельного решения 1. Концентрации двух растворов одинаковы. В первом присутствуют одновалентные ионы соли NaCl, а во втором – двухвалентные ионы соли CaHPO4. Во сколько раз отличаются радиусы экранирования зарядов в этих растворах, если их диэлектрические проницаемости близки, температуры одинаковы. 2. Физиологический раствор Рингера имеет следующий состав: [NaCl]=105 мМоль/л (мМ); [KCl]=5 мМ; [Na2HPO4]=25 мМ; [CaCl2]=2 мМ. Определить ионную силу I раствора Рингера и толщину ионной атмосферы r D при температуре 25 oC. 3. Рассчитать дебаевские радиусы экранирования заряда для указанных растворов солей заданных концентраций. Найти отношение полученных значений радиусов экранирования. а) KCl (0,1 г/л) и CaCl2 (10 г/л); б) NaCl (1 г/л) и MgCl2 (0,5 г/л).
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 3023; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.007 с.) |

 ; б) Т пл =
; б) Т пл =  ; в) Т пл =
; в) Т пл =  ;
;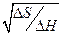 ; д) Т пл =
; д) Т пл =  .
. выразим толщину мембраны d:
выразим толщину мембраны d:  и подставим численные данные:
и подставим численные данные: м = 5,9 нм.
м = 5,9 нм. ,
, м2/с.
м2/с. ; б)
; б)  ; в)
; в)  ;
; ; д)
; д)  .
.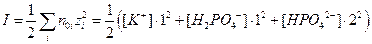 =0,25 М.
=0,25 М. =[8,85·10-12Кл2/(Н·м2)·74·1,38·10-23Дж/К·311К/
=[8,85·10-12Кл2/(Н·м2)·74·1,38·10-23Дж/К·311К/ .
. .
. .
. .
. раз меньше, чем для соли KCl.
раз меньше, чем для соли KCl.


