Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 7. Симптоматология ИМ.Содержание книги
Поиск на нашем сайте
В течении трансмурального ИМ (инфаркта с зубцом Q) принято выделять 4 периода; 1) острейший; 2) острый; 3) подострый и 4) постинфарктный периоды. Клиническая картина каждого из них складывается из: · типичных клинических проявлений неосложненного течения ИМ; · клинической симптоматики многочисленных осложнений. В то же время следует иметь в виду, что “ неосложненный” ИМ — весьма условное понятие, поскольку в большинстве случаев трудно представить себе трансмуральное поражение ЛЖ, которое не сопровождалось хотя бы минимальными признаками левожелудочковой недостаточности, нарушениями ритма сердца или рефлекторным коллапсом. Острейший период Острейший период трансмурального ИМ — это время от появления первых клинических и/или инструментальных (электрокардиографических) признаков острой ишемии миокарда до начала формирования очага некроза (около 2–3 ч). На протяжении этого периода морфологические изменения в сердечной мышце еще обратимы, и при своевременном применении тромболитических средств сохраняется возможность восстановления коронарного кровотока и предупреждения образования некроза миокарда. Первые клинические проявления ИМ связаны с завершением процесса полной тромботической окклюзии КА или с внезапным ее развитием (при отсутствии у больного признаков продромального периода). Различают несколько клинических вариантов начала ИМ: · болевой (ангинозный) вариант начала (status anginosus); · астматический вариант (status asthmaticus); · абдоминальный вариант (status abdominalis); · аритмический вариант; · цереброваскулярный вариант; · малосимптомное (бессимптомное) начало ИМ. Ниже приведена клиническая картина наиболее распространенного варианта начала ИМ — ангинозного, который наблюдается в 80–95% всех случаев ИМ. Жалобы Приступ интенсивных болей в сердце является наиболее характерным клиническим признаком начала ИМ. Боль локализуется за грудиной, нередко распространяясь на всю прекардиальную область слева и справа от грудины и даже на область эпигастрия. В большинстве случаев боль иррадиирует в левую руку, левое плечо, лопатку, шею, реже — в межлопаточное пространство, нижнюю челюсть, в обе руки и т.п. Интенсивность и характер боли обычно отличаются от приступа стенокардии: больные ИМ характеризуют ее как необычно сильную, мучительную, “жестокую” боль сжимающего, давящего, распирающего или жгучего характера, нередко сопровождающуюся страхом смерти. Боль возникает внезапно, быстро достигая максимальной интенсивности. Она не купируется при сублингвальном приеме нитроглицерина или изосорбида динитрата. Часто боль купируется только после применения наркотических анальгетиков (“предельная” или “морфинная” боль). Продолжительность боли в типичных случаях достигает 40–60 мин, иногда сохраняясь часы и сутки, оправдывая свое название — status anginosus. Иногда возможно как бы “волнообразное изменение интенсивности болей: после 20–30 мин предельных по силе, “морфинных”, болей наступает кратковременное (на 10–15 мин) ослабление боли, после чего она возобновляется с новой силой. Следует помнить, что боль при ИМ иногда может пройти самостоятельно, даже если больному не была оказана соответствующая медицинская помощь. Гораздо реже болевой синдром при ИМ может быть не столь интенсивным и продолжительным. В этих случаях боли могут быть вполне “терпимыми”, их продолжительность не превышает 15–20–30 мин, иногда боли могут купироваться после приема нескольких таблеток нитроглицерина. Острая сосудистая недостаточность. У большинства больных трансмуральным ИМ возникновение интенсивного болевого приступа сопровождается признаками болевого шока. Больные жалуются на внезапно появившуюся резкую слабость, головокружение, выраженную потливость, сердцебиения (тахикардию), похолодание конечностей. Появляется апатия и адинамия, а в некоторых случаях даже кратковременное затемнение сознания. Отмечается снижение АД. Описанные клинические признаки указывают на возникновение острой сосудистой недостаточности, развивающейся, как правило, на высоте болевого синдрома. В результате рефлекторного расширения вен органов брюшной полости и скелетных мышц происходит депонирование крови в этих сосудистых областях, уменьшение притока крови к сердцу, развивается гиповолемия, снижение АД и гипоперфузия головного мозга. Эта клиническая картина острой сосудистой недостаточности очень напоминает начальные клинические проявления истинного кардиогенного шока, обусловленные резким падением сердечного выброса. Однако в отличие от него, признаки рефлекторного болевого шока кратковременны, быстро, в течение нескольких минут, проходят самостоятельно или при применении лекарственных средств, повышающих сосудистый тонус. Одышка. Субъективные проявления острой левожелудочковой недостаточности наблюдаются более чем у половины больных трансмуральным ИМ, в том числе у пациентов с болевым (ангинозным) вариантом инфаркта. На фоне продолжающегося болевого приступа или после его купирования появляется ощущение нехватки воздуха, дыхательный дискомфорт, одышка, которые усиливаются в горизонтальном положении больного с низким изголовьем. Эти признаки связаны с быстро развивающейся на фоне выраженной ишемии миокарда диастолической и систолической дисфункцией ЛЖ, повышением КДД в желудочке, среднего давления в ЛП и венах малого круга кровообращения и венозным застоем в легких. Следует подчеркнуть, что развитие более тяжелых проявлений острой левожелудочковой недостаточности (сердечной астмы или альвеолярного отека легких) в острейшем периоде болевого ИМ не характерны. Аритмии. У большинства больных трансмуральным ИМ (до 90%) при мониторном наблюдении можно выявить разнообразные нарушения ритма и проводимости, в том числе возникающие в самый ранний период заболевания. Большинство из них сопровождаются жалобами больных на сердцебиения и перебои в работе сердца. Физикальное исследование Целью физикального исследования больного ИМ является не столько установление диагноза ИМ, который подтверждается в основном данными лабораторногого и ЭКГ-исследования, сколько оценка функционального состояния сердечно-сосудистой системы и своевременная диагностика тяжелых осложнений инфаркта. Осмотр. При общем осмотре в первые минуты или 1–1,5 ч, прошедшие от начала заболевания, обращает на себя внимание выраженное возбуждение и двигательное беспокойство больных, испытывающих в это время сильную боль. Они пытаются менять позу, иногда даже ходить по комнате, садиться в кресло, ложиться в постель в поисках положения, облегчающего страдания. Этот признак, характерный для больных ИМ, отличает их от пациентов со стенокардией, которые во время болевого приступа как бы застывают на месте. После купирования болевого синдрома возбуждение больных с развивающимся ИМ, как правило, проходит. Исключение составляют случаи прогрессирующей левожелудочковой недостаточности, сопровождающейся внезапно появившейся и быстро нарастающей одышкой и удушьем. При осмотре нередко отмечаются бледность кожных покровов, похолодание конечностей и выраженная потливость, указывающие на возможное развитие острой сосудистой недостаточности (кратковременного рефлекторного болевого шока) или на начальные клинические проявления истинного кардиогенного шока (см. ниже). В большинстве случаев определяется цианоз губ. Выраженный цианоз, положение ортопноэ в сочетании с влажными мелкопузырчатыми хрипами в нижних отделах легких и увеличением частоты дыхательных движений свидетельствуют о наличии острой левожелудочковой недостаточности. Пальпация и перкуссия сердца. При пальпации сердца может отмечаться локальная болезненность в левой прекардиальной области. При перкуссии сколько-нибудь заметного расширения полости ЛЖ в острейший период заболевания выявить не удается. Исключение составляют больные с предшествующими инфаркту заболеваниями, сопровождающимися дилатацией ЛЖ (АГ, атеросклеротический и постинфарктный кардиосклероз и др.). Аускультация сердца. В острейшем периоде ИМ у больных можно выявить несколько аускультативных феноменов: 1. ОслаблениеI тона на верхушке, связанные с уменьшением сократимости ишемизированного миокарда ЛЖ. 2. Ослабление II тона, обусловленное замедлением раннего диастолического расслабления ЛЖ или снижением давления в аорте. При повышении давления в легочной артерии, обусловленном венозным застоем в малом круге кровообращения, определяется акцент II тона на легочной артерии. Наконец, у некоторых больных с ИМ и выраженным атеросклеротическим уплотнением аорты можно выслушать акцент II тона на аорте. 3. Синусовая тахикардия, которая в первые 2–3 ч от начала ИМ свидетельствует, скорее, не о наличии сердечной недостаточности, а о выраженной активации САС, происходящей на фоне болевого стресса. 4. Синусовая брадикардия, иногда выявляемая у больных ИМ, связана, наоборот, с преобладанием активности парасимпатической нервной системы и угнетением автоматизма СА-узла, что особенно часто наблюдается при ИМ заднедиафрагмальной области ЛЖ. Кроме того, в более редких случаях брадикардия может быть обусловлена СА-блокадой или АВ-блокадой II и даже III степени. Артериальный пульс и АД. Артериальное давление в первые минуты и часы ИМ может возрастать, что нередко связано с повышенной активностью САС, повышенной концентрацией катехоламинов в крови, появляющимися в результате болевого и психоэмоционального стресса. При развитии острой сосудистой недостаточности АД снижается, главным образом, за счет систолического АД. Одновременно наблюдается уменьшение наполнения, напряжения и величины артериального пульса, а также его учащение. Острый период Острый период ИМ соответствует времени формирования очага некроза и возникновения так называемого резорбционно-некротического синдрома, связанного с общей реакцией организма на всасывание (резорбцию) некротических масс в кровь. В этот период начинается также сложный процесс ремоделирования ЛЖ, сопровождающийся нарушением функционального состояния сердечно-сосудистой системы. При неосложненном течении ИМ острый период обычно продолжается около 7–10 дней. Жалобы Боль в области сердца. При отсутствии осложнений боли в области сердца в этот период обычно не возникают. Сохранение болевого синдрома в течение нескольких дней от начала заболевания может свидетельствовать о дальнейшем распространении тромботического процесса в коронарной системе и расширении зоны ишемического поражения сердечной мышцы или о вовлечении в патологический процесс перикарда. Лихорадка. На 2–3-й день заболевания повышается температура тела до 37,2–38°С и выше, что является одним из первых клинических признаков резорбционно-некротического синдрома. Лихорадка сохраняется обычно 3–4 дня, редко около 1 недели. Более длительное повышение температуры тела может указывать на развитие осложнений ИМ: пневмонии, тромбоэндокардита, инфаркта легкого и др. Одышка и некоторые другие признаки левожелудочковой недостаточности нередко наблюдаются в остром периоде трансмурального ИМ, свидетельствуя о дисфункции ЛЖ. Чувство нехватки воздуха, небольшая тахикардия в течение короткого времени могут выявляться даже в тех случаях, которые расцениваются в целом как неосложненное течение инфаркта. В более тяжелых случаях может развиться интерстициальный или альвеолярный отек легких, который расценивают как очень серьезное осложнение ИМ. Аритмии. В остром периоде заболевания сохраняется высокий риск возникновения разнообразных нарушений ритма и проводимости, в том числе пароксизмальной ЖТ и ФЖ. При неосложненном течении ИМ у больных могут сохраняться умеренно выраженная синусовая тахикардия или брадикардия, единичные экстрасистолы. Физикальное исследование Осмотр. Неосложненное течение острого периода ИМ, как правило, не сопровождается какими-нибудь специфическими изменениями, выявляемыми при общем осмотре. При исследовании сердечно-сосудистой системы в этот период можно выявить небольшое снижение систолического АД. Нередко выявляется умеренная синусовая тахикардия, обусловленная СН или связанная с наличием лихорадки. При перкуссии сердца можно выявить небольшое смещение влево левой границы относительной тупости, что может указывать на начавшееся ремоделирование ЛЖ, его дилатацию и снижение сократимости. При аускультации сердца I тон ослаблен, иногда значительно, что связано с резким снижением сократительной способности миокарда ЛЖ, его дилатацией или возникновением относительной недостаточности митрального клапана в результате поражения папиллярных мышц. В последнем случае ослабление I тона нередко сочетается с систолическим шумом на верхушке, проводящимся в левую подмышечную область. Примерно у 1/3 больных ИМ в остром периоде можно выслушать протодиастолический или пресистолический ритмы галопа. Протодиастолический ритм галопа, обусловленный появлением патологического III тона сердца, свидетельствует о прогрессирующем падении сократимости ЛЖ и его объемной перегрузке. Диагностическое значение этого аускультативного феномена повышается при наличии других признаков левожелудочковой недостаточности (одышка, цианоз, влажные хрипы в легких и т.п.). Иногда на верхушке сердца можно выслушать пресистолический ритм галопа, связанный с появлением патологического IV тона сердца, обусловленного повышением конечно-диастолического давления в ЛЖ и выраженной диастолической ригидностью ишемизированного миокарда. На 2–4 сутки заболевания при аускультации можно выслушать шум трения перикарда, обусловленный вовлечением в патологический процесс листков перикарда (асептический перикардит), что рассматривается как осложнение ИМ (см. ниже). Наконец, в более редких случаях на верхушке может появляться систолический шум, сочетающийся с ослаблением I тона, обусловленный поражением папиллярных мышц и развитием относительной недостаточности митрального клапана. Максимум шума определяется на верхушке. Шум проводится в левую подмышечную область. Подострый период В подостром периоде ИМ постепенно формируется соединительнотканный рубец, замещающий некротические массы. Продолжается также процесс ремоделирования ЛЖ. Продолжительность подострого периода колеблется в широких пределах и зависит, прежде всего, от объема очага некроза, состояния окружающего миокарда, не вовлеченного в некротический процесс, степени развития коллатералей, наличия сопутствующих заболеваний и осложнений ИМ. Обычно продолжительность подострого периода составляет 4–6 недель. В целом подострый период протекает относительно более спокойно и благоприятно, чем два предыдущих периода. Состояние больных постепенно стабилизируется. При неосложненном течении заболевания боли в сердце и тяжелые жизнеопасные нарушения ритма (пароксизмальная ЖТ и ФЖ) отсутствуют. Уменьшается частота возникновения экстрасистолии, синусовой тахикардии и других аритмий. У больных с признаками АВ-блокад I и II степени, развившимися в остром периоде, нередко восстанавливается атриовентрикулярная проводимость. Уменьшаются проявления сердечной недостаточности (одышка, тахикардия), если они имели место в остром периоде. В других случаях, при обширном поражении сердечной мышцы, признаки застойной сердечной недостаточности могут прогрессировать, особенно на фоне активизации режима больного. При этом нарастает одышка, тахикардия, появляются отеки на ногах, увеличивается печень, сохраняются влажные хрипы в нижних отделах легких и т.д. В большинстве случаев в подостром периоде выявляется тенденция к нормализации АД, хотя нередко уровень систолического АД оказывается ниже, чем до развития ИМ. При аускультации обычно сохраняется приглушенность I тона на верхушке, однако протодиастолический и пресистолический ритмы галопа выслушиваются реже. У больных с относительной недостаточностью митрального клапана, обусловленной дисфункцией клапанного аппарата (папиллярных мышц) продолжает выслушиваться систолический шум на верхушке. Шум трения перикарда отсутствует. Постинфарктный период В ближайшем постинфарктном периоде в области рубца увеличивается количество коллагена и завершается его уплотнение (консолидация рубца). Одновременно продолжается формирование ряда компенсаторных механизмов, направленных на поддержание гемодинамики на должном уровне (гиперфункция и гипертрофия неповрежденного миокарда, умеренная дилатация ЛЖ, способствующая, согласно механизму Старлинга, некоторому увеличению сердечного выброса и др.). Клиническая картина постинфарктного периода зависит от влияния многих факторов: · объема постинфарктного рубца; · функционального состояния окружающего миокарда; · формирования компенсаторных механизмов сердечной деятельности; · скорости дальнейшего прогрессирования коронарного атеросклероза и т.д. Если первые три фактора, по сути, определяют степень гемодинамических нарушений на протяжении 2–6 мес. после ИМ, то в отдаленном постинфарктном периоде все большее значение приобретает дальнейшее прогрессирование коронарного атеросклероза, ведущего к новым нарушениям коронарного кровообращения (эпизодам нестабильной стенокардии, повторным ИМ, внезапной сердечной смерти и т.п.). Уже в ближайшем постинфарктном периоде возможно возобновление стенокардии. Относительно редкие приступы стабильной стенокардии напряжения обычно возникают при многососудистом поражении коронарного русла и обусловлены преходящими нарушениями перфузии миокарда в бассейне так называемой “инфаркт-несвязанной КА”. Если же в этот период появляются частые ангинозные приступы, возникающие у больного при малейшей физической нагрузке, психоэмоциональном напряжении или в покое, это расценивают как один из вариантов нестабильной стенокардии (ранняя постинфарктная стенокардия), требующей неотложной терапии. Вторая группа субъективных симптомов, наблюдающихся у части больных в послеинфарктном периоде, связана с прогрессированием хронической сердечной недостаточности (одышка, тахикардия, отеки ног, нарастающая слабость, утомляемость и др.). Наконец, в постинфарктном периоде сохраняется повышенный риск возникновения различных нарушений ритма и проводимости. Данные объективного исследования, проведенного в постинфарктном периоде, нередко подтверждают ту или иную степень нарушения гемодинамики (влажные хрипы в легких, отеки, увеличение печени, цианоз, дилатация ЛЖ и др.). Постинфарктный синдром, впервые описанный в 1955 г. Дресслером, — это аутоиммунное поражение перикарда, плевры и легких, возникающее обычно на 2–6-й неделе от начала ИМ. Типичная триада, характерная для постинфарктного синдрома (перикардит, плеврит, пневмонит), иногда сочетается с аутоиммунным поражением синовиальных оболочек суставов. Постинфарктный синдром связывают с обнаружением в организме больных ИМ аутоантител к миокардиальным и перикардиальным антигенам. Клиническая картина постинфарктного синдрома различается у разных больных в зависимости от преимущественного поражения перечисленных серозных оболочек и легких. Однако обязательным является асептический аутоиммунный процесс в перикарде — перикардит. Перикардит при синдроме Дресслера обычно протекает нетяжело. На 2–6-й неделе заболевания появляются боли в области сердца, которые носят постоянный, неострый характер и не купируются нитроглицерином. Их продолжительность достигает 30–40 мин и больше. Одновременно повышается температура тела до субфебрильных цифр, появляется слабость. Болевой синдром и лихорадка, как правило, исчезают через несколько дней. Количество экссудата, накапливающегося в полости перикарда, невелико и не приводит к нарушениям гемодинамики. Изменения ЭКГ обычно мало выражены. При двухмерной ЭхоКГ можно обнаружить уплотнение листков перикарда и их небольшую сепарацию. Плеврит при постинфарктном синдроме может быть как односторонним, так и двусторонним. В начале заболевания появляются боли в грудной клетке, усиливающиеся при дыхании, выслушивается шум трения плевры. Когда в плевральной полости накапливается экссудат, боли прекращаются, и шум трения не выслушивается. При объективном исследовании обнаруживают небольшое притупление перкуторного звука и ослабление дыхания на стороне поражения. Следует помнить, что при развитии междолевого плеврита физикальные изменения в легких могут быть очень скудными. Диагноз подтверждается только при рентгенологическом исследовании. Аутоиммунный пневмонит при постинфарктном синдроме выявляется несколько реже, чем перикардит и плеврит. Субъективно пневмонит проявляется усугублением одышки, что нередко расценивается как признак левожелудочковой недостаточности. Однако назначение диуретиков или инотропных лекарственных средств не приносит облегчения. При объективном исследовании в легких выявляется ограниченный участок, в котором на фоне несколько ослабленного дыхания на высоте вдоха выслушивается крепитация. Иногда могут появляться мелкопузырчатые влажные хрипы. Лишь изредка, если очаг иммунного воспаления достаточно велик, можно выявить небольшое притупление перкуторного звука. В остальных случаях над легкими определяется ясный легочный звук. Осложнения ИМ К числу ранних осложнений ИМ, чаще всего развивающихся в острейшем или остром периодах заболевания, относятся:
· острая левожелудочковая недостаточность (отек легких);
· кардиогенный шок;
· желудочковые и наджелудочковые нарушения ритма;
· нарушения проводимости (СА-блокады, АВ-блокады, блокады ножек пучка Гиса);
· острая аневризма ЛЖ;
· внешние и внутренние разрывы миокарда, тампонада сердца;
· асептический перикардит (эпистенокардитический);
· тромбоэмболии.
2. К поздним осложнениям ИМ относятся: ранняя постинфарктная стенокардия;
застойная сердечная недостаточность;
синдром Дресслера;
хроническая аневризма ЛЖ и др. Таким образом, можно выделить несколько синдромов, которые могут формировать клинику ИМ. 1.Болевой синдром. 2.Синдром острой сердечной недостаточности. 3.Синдром острой сосудистой недостаточности. 4. Резербционно - некротический синдром. 5. Синдром нарушения ритма сердца. 6. Синдром Дреслера. 7. Синдром асептического (перинекротического) перикардита. Вопрос 8. Лабораторная и инструментальная диагностика ИМ. Лабораторное подтверждение острого ИМ основано на выявлении: 1) неспецифических показателей тканевого некроза и воспалительной реакции миокарда; 2) гиперферментемии и 3) увеличении содержания в крови миоглобина и тропонинов. Неспецифическая реакция организма на возникновение острого ИМ связана, прежде всего, с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь и местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне. Основными лабораторными признаками, отражающими эти процессы, являются: 1.. Лейкоцитоз, не превышающий обычно 12–15 х 109/л. 2. Анэозинофилия. 3. Небольшой палочкоядерный сдвиг формулы крови влево. 4. Увеличение СОЭ. Следует подчеркнуть, что выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Необходимо также помнить, что правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ. Маркеры некроза миокарда Тропонины. Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является повышение концентрации тропонинов I и Т, входящих, как известно, в состав тропомиозинового комплекса сократительного миокарда. В норме кардиоспецифические тропонины в крови не определяются или их концентрация не превышает самых минимальных значений, устанавливаемых отдельно для каждой клинической лаборатории. Некроз кардиомиоцитов сопровождается сравнительно быстрым и значительным увеличением концентрации тропонинов I и Т, уровень которых начинает превышать верхнюю границу нормы уже через 2–6 ч после ангинозного приступа и сохраняется высоким в течение 1–2 недель от начала инфаркта (рис. 8 а). Миоглобин. Очень чувствительным, но малоспецифичным маркером некроза является концентрация миоглобина в крови. Его повышение наблюдается через 2–4 ч после ангинозного приступа и сохраняется в течение 24–48 ч после него. Выход миоглобина из сердечной мышцы и повышение его концентрации в крови происходит еще до формирования очага некроза, т.е. на стадии выраженного ишемического повреждения сердечной мышцы. Следует также помнить, что увеличение концентрации миоглобина в крови может быть обусловлено и другими причинами (кроме инфаркта): болезнями и травмами скелетных мышц, большой физической нагрузкой, алкоголизмом, почечной недостаточностью. Изменение содержания миоглобина при остром ИМ представлено в табл. 3 и на рис. 10 а. Таблица 2 Изменение содержания миоглобина и тропонинов при остром инфаркте миокарда
Рис. 10. Динамика концентрации тропонинов и миоглобина (а) и активности некоторых ферментов сыворотки крови (б) при остром инфаркте миокарда. Красным цветом обозначены маркеры некроза, рекомендованные Европейским кардиологическим обществом и ВНОК РФ для лабораторной диагностики инфаркта миокарда (тропонины I и Т, МВ КФК,общая КФК). Пунктиром обозначены верхняя граница нормы и уровень, превышение которого следует расценивать как признак некроза сердечной мышцы («ИМ»). М — кривая концентрации миоглобина, Т — тропонинов К сожалению, далеко не все клиники в настоящее время имеют возможность лабораторного определения концентрации тропонинов и миоглобина в крови. Поэтому на практике сохраняет свое значение определение других, менее чувствительных и специфичных, маркеров некроза миокарда. Наиболее ценным из них для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови: · креатинфосфокиназы (КФК), особенно ее МВ-фракции (МВ КФК); · лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1); · аспартатаминотрансферазы (АсАТ). Основной причиной повышения активности ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь. Динамика активности этих ферментов при остром ИМ представлена в табл. 3 и на рис.10 б. Таблица 3 Изменение активности некоторых ферментов при остром инфаркте миокарда
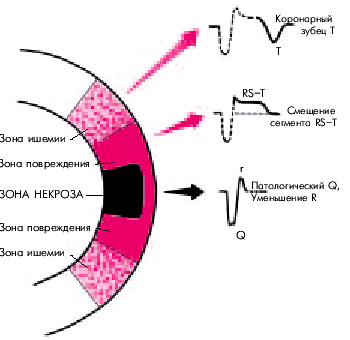
Креатинфосфокиназа (КФК) и ее фракция МВ КФК. Более специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ КФК). Ее активность начинает возрастать уже через 4–6 ч, достигает максимума через 12–18 ч и возвращается к исходным цифрам через 48–72 ч от начала ангинозного приступа. Особое значение придается динамике активности фермента: достоверными признаками острого ИМ считают нарастание активности МВ КФК на 25% в двух пробах, взятых с 4-часовым интервалом или постепенное нарастание активности фермента на протяжении 24 ч. Информативным является повышение активности МВ КФК более 10–13 ЕД/л. Активность общей КФК при ИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 8 б). Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций. В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Степень повышения активности МВ КФК в крови в целом хорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активность МВ КФК. Аспартатаминотрансфераза (АсАТ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта). Через 4–7 суток концентрация АсАТ возвращается к исходному уровню. Изменение активности АсАТ также не специфично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца — АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33. Следует помнить, что окончательная трактовка результатов исследования ферментов и сократительных белков в сыворотке крови при остром ИМ возможна только в комплексе с оценкой клинической картины заболевания, изменений ЭКГ и данных других лабораторных и инструментальных методов исследования. Следует отметить, что в стандарты клинической практики вошло определение уровня КФК МВ и тропонинов. Для постановки диагноза ИМ значимо разовое двухкратное увеличение КФК МВ или любое увеличение этого фермента в динамике с интервалом 12 часов, а также любой уровень увеличения тропонинов. ЭКГ диагностика Инфаркт миокарда с зубцом Q Согласно представлениям Bayley, нарушение коронарного кровообращения при ИМ приводит к формированию трех зон патологических изменений: вокруг участка некроза располагаются зоны ишемического повреждения и ишемии (рис. 11). В отведениях, активный электрод которых расположен непосредствено над областью ИМ, каждая из этих зон участвует в формировании следующих ЭКГ-изменений. 1. Зона некроза — патологический зубец Q (продолжительностью больше 30 мс) и резкое уменьшение амплитуды зубца R или комплекс QS. 2. Зона ишемического повреждения — смещение сегмента RS–T выше (при трансмуральном ИМ) или ниже изолинии (при субэндокардиальном поражении сердечной мышцы). 3. Зона ишемии — “коронарный” (равносторонний и остроконечный) зубец Т (высокий положительный при субэндокардиальном ИМ и отрицательный — при трансмуральном ИМ). Рис. 11. Три зоны патологических изменений в сердечной мышце при остром инфаркте миокарда (по Bayley) и их отражение на ЭКГ (схема)
ЭКГ изменяется в зависимости от времени, прошедшего от начала формирования ИМ. Динамика ЭКГ в зависимости от стадии инфаркта представлена на рис. 10.
Рис.12. Динамика изменений ЭКГ в острой (а–е), подострой (ж) и рубцовой (з) стадиях инфаркта миокарда. Объяснение в тексте Острейшая стадия (до 2-х ч от начала ИМ). В течение нескольких минут после прекращения коронарного кровотока и возникновения ангинозного приступа в сердечной мышце обычно выявляется зона субэндокардиальной ишемии, для которой характерно появление высоких коронарных зубцов Т и смещение сегмента RS–Т ниже изоэлектрической линии (рис. 12, а, б). На практике эти изменения по понятным причинам регистрируются достаточно редко, и врач, как правило, имеет дело с более поздними электрокардиографическими признаками острейшей стадии ИМ. Когда зона ишемического повреждения распространяется до эпикарда, на ЭКГ фиксируется смещение сегмента RS–Т выше изолинии (трансмуральное ишемическое повреждение). Сегмент RS–Т при этом сливается с положительным зубцом Т, образуя так называемую монофазную кривую, напоминающую по форме ТМПД (рис. 12, в). Острая стадия характеризуется быстрым, в течение 1 — 2 суток, формированием патологического зубца Q или комплекса QS и снижением амплитуды зубца R, что указывает на образование и расширение зоны некроза (рис.10, г, д). Одновременно в течение нескольких дней сохраняется смещение сегмента RS–T выше изолинии и сливающегося с ним вначале положительного, а затем отрицательного зубца Т. Через несколько дней сегмент RS–T приближается к изолинии, а к концу 1-й недели или в начале 2-й недели заболевания становится изоэлектричным, что свидетельствует об уменьшении зоны ишемического повреждения (рис. 12, е). Отрицательный коронарный зубец Т резко углубляется и становится симметричным и заостренным (повторная инверсия зубца Т). В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20–25-х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS–T расположен на изолинии (рис. 12, ж). Рубцовая стадия ИМ характеризуется сохранением в течение многих лет патологического зубца Q или комплекса QS и наличием отрицательного, сглаженного или положительного зубца Т (рис. 12, з). Таким образом, прямыми признаками острой стадии ИМ с зубцом Q являются: · патологический зубец Q (или комплекс QS); · элевация (подъем) сегмента RS–T и · отрицательный (коронарный) зубец Т. В зависимости от локализации ИМ и его распространенности эти изменения обнаруживаются в различных ЭКГ-отведениях (табл. 4).
Таблица 4 Прямые и реципрокные ЭКГ-признаки инфаркта миокарда с зубцом Q различной локализации
Познавательные статьи:
|
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.210.35 (0.015 с.) |