
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состав топлив, воздуха и выхлопных газов.Содержание книги
Поиск на нашем сайте
Рабочая смесь – смесь топлива, воздуха и остаточных газов. Процесс образования рабочей смеси представляет совокупность процессов распыливания топлива и его перемешивания с поступившим в цилиндр двигателя свежим воздухом и газами, оставшимися в нем от предыдущего цикла. Процессы смесеобразования и сгорания схематически изображены на схеме (рисунок 1). Они частично перекрывают друг друга, т.е. резкой границы между ними нет.
Рисунок 1 Схематическое изображение процессов смесеобразования и сгорания
В автотракторных ДВС могут применяться следующие способы образования рабочей смеси: - внешний (ДсИЗ); - внутренний (дизели и ДсИЗ с впрыском бензина в цилиндр); - комбинированный (дизели с двухфазной топливоподачей и др.). Способ смесеобразования во многом определяет протекание процесса сгорания топлива. Вместе с тем следует отметить, что основные химические реакции не зависят от способа смесеобразования. Топливо состоит в основном из углерода (С), водорода (Н2) и кислорода. В 1 кг дизельного топлива примерно содержится: углерода - 0,87 кг, водорода - 0,126 кг, кислорода - 0,004 кг. Общую формулу молекул топлива можно записать в виде СпH2п+2. Если для общности рассуждений принять, что в одном кг топлива содержится У кг углерода, В кг водорода и К кг кислорода, то можно записать: У + В + К = 1 кг Процесс сгорания топлива – это процесс окисления его составных элементов (углерод и водород) кислородом. Горение углерода: С + О2 = СО2, т.е. для сгорания 1 кг – атома С требуется 1 кмоль О2. Справка: Кмоль (или килограмм-молекула) газа – количество кг газа, численно равное молекулярной массе газа. Например, масса одного кмоля кислорода – 32 кг, водорода - 2 кг. Из уравнения также видно, что из 1 кмоля О2 образуется 1 кмоль СО2. Отметим, что согласно закону Авогадро, 1 кмоль любого газа при одинаковых условиях занимает одинаковый объем. Следовательно, при горении углерода объем газа до сгорания оказывается равным объему газа после сгорания (объемом углерода, входящего в состав жидкого топлива пренебрегаем). Заметим, что при недостатке кислорода углерод сгорает не полностью, образуя окись углерода СО (угарный газ). Учтя, что 1 кг-атом углерода равен 12 кг, составим пропорцию: на 12 кг С требуется 1 кмоль О2;
на У кг С (содержащиеся в 1 кг топлива) требуется Х кмоль О2. Отсюда получаем, что для полного сгорания углерода 1 кг топлива требуется Х=У/12 кмолей О2 Горение водорода: 2Н2 + О2 = 2Н2О Для водорода 1 кмоль = 2 кг. Составив ту же пропорцию: на 4 кг Н2 требуется 1 кмоль О2; на В кг Н2 требуется Z кмоль О2, получим: Из уравнения сгорания водорода также следует, что при сгорании водорода при затрате 1 кмоль О2 образуется 2 кмоля паров воды, т.е. число молей газов возрастает в 2 раза. Следовательно, объем увеличивается в 2 раза (объемом водорода в объеме топлива пренебрегаем). Это означает, кроме всего проче го, и то, что при использовании в качестве топлива водорода, если бы даже тепло не выделялось, давление все равно бы поднималось и работа совершалась (из-за увеличения объема газа). Общее количество кислорода, необходимого для полного сгорания одного кг топлива, получим сложив количества кислорода на сгорание углерода и водорода и вычтя кислород, находящийся в самом топливе (К/32) и вступающий затем в реакции окисления. Для полного сгорания 1 кг топлива потребуется кислорода (кмолей):
где: Справка: В настоящее время во всем мире на сжигание добываемого топлива расходуется ежегодно 6 млрд. тонн кислорода. На дыхание затрачивается 700 млн тонн.
Для среднего содержания элементов топлива (У=0,87 кг, В=0,126 кг и К=0,004 кг) находим:
В пересчете на нормальные условия (760 мм рт.ст. и 0°С) такое количество занимает объем:
1 кмоль воздуха содержит 0,21 кмоля О2 (закон Авогадро). Составим пропорцию для определения количества кмолей воздуха (Lo), необходимого для полного сжигания 1 кг топлива: в 1 кмоле воздуха - 0,21 кмоля О2; в Lo кмоле воздуха - K’ кмоля О2. Отсюда получаем Lo (в кмоль воздуха на 1 кг топлива):
Учитывая, что для воздуха: 1 кмоль» 28,95 кг, можно вычислить и массу воздуха, необходимую для обеспечения полного сгорания 1 кг топлива (
|
|||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 393; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.176.80 (0.008 с.) |


 кмолей О2, т.е для сгорания водорода требуется В/4 кмолей кислорода.
кмолей О2, т.е для сгорания водорода требуется В/4 кмолей кислорода.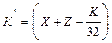
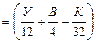 , (1)
, (1) - число кмолей кислорода, содержащегося в 1 кг самого топлива.
- число кмолей кислорода, содержащегося в 1 кг самого топлива. =28,95× Lo, кг воздуха/кг топлива.
=28,95× Lo, кг воздуха/кг топлива.
 , м3 воздуха/кг топлива.
, м3 воздуха/кг топлива.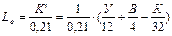 , (2)
, (2) ):
):


