
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Химические свойства кислородсодержащих соединений ( спиртов и уксусной кислоты)Содержание книги
Поиск на нашем сайте
Карбоновые кислоты. Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.
– COOH – карбоксильная группа
Физические свойства Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Химические свойства 1. Диссоциация CH3COOH 2. Взаимодействие с металлами 2CH3COOH + Mg à (CH3 – CO)2Mg + H2 3. С основными и амфотерными оксидами CH3COOH + MgO à (CH3 – COO)2Mg + H2O 4. С гидроксидами CH3COOH + NaOH à CH3 – COONa + H2O 5. С солями более слабых и летучих кислот 2CH3COOH + CaCO3 à (CH3COO)2Ca + H2CO3 (разлагается на H2O и CO2 6. Получение ангидрида
ангидрит укс. кислоты 7. Со спиртами CH3 Уксусно-пентиловый Эфир Получение 1. Окисление алканов 2CH4 + 3O2 à 2H 2. Окисление спиртов C2H5OH + O2 à CH3 Применение уксусной кислоты: Получение лекарств, ацетатного шёлка, солей, фруктовых эссенций, растворителей для лаков, киноплёнки, красителей для тканей, стимуляторов роста растений.
Выполнить самостоятельно:
1) Для чего используется уксусная кислота при консервации продуктов? 2) Напишите меры предостороженности при работе с кислотами. 3) Чем отличается карбоксильная группа от альдегидной группы? 4) Закончите уравнения химических реакций: CH3COOH + КOH = 2CH3COOH + Na =
Лабораторная работа
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 8; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.88.155 (0.006 с.) |

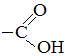 – карбоксильная группа
– карбоксильная группа CH3COO-- + H+
CH3COO-- + H+
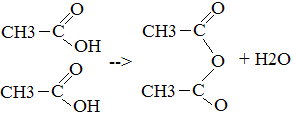
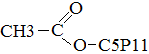 + H2O
+ H2O


