
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Присоединение галогенно-водородныхСодержание книги
Поиск на нашем сайте
этин этен CH2 = CH2 +H2 à CH3 – CH3 этен этан 2. Присоединение галогенов + Cl2 à CHCl = CHCl этин 1,2 дихлорэтан CHCl = CHCl + Cl2 à CHCl2 – CHCl2 1,1,2,2 тетрахлорэтан 3. Присоединение галогенно-водородных + HCl à CH2 – CHCl 4. Гидратация (реакция Кучерова) уксусный альдегид II. Реакции окисления 1. Горение 2C2H2 + 5O2 à 4CO2 + 2H2O 2. Обесцвечивание KMnO4 III. Полимеризация 3C2H2 à C6H6 (t, активированный уголь) бензол Получение 1) Из метана 2CH4 à C2H2 2) Из карбида кальция CaC2 + 2HOH à C2H2 Применение Винилацетилен, щавельная кислота, винилхлорид, ацельдегид, сварка и резка металлов. Выполнить самостоятельно: 1) Чем отличаются алкины от алканов и алкенов? 2) Закончите уравнения химических реакций: С2Н2 + Н2 = СН=СН +Br2 =
Топливо ( нефтепродукты) Существует три вида топлива: твердое жидкое газообразное торф, сланцы, бурый уголь, каменный уголь, антрацит мазут, керосин, бензин
метан Процессы превращения топлива в природе во времени можно отобразить схемой: Торф - бурый уголь – каменный уголь – антрацит При сжигание топлива всегда возникает пламя. Цвет пламени зависит как от количества твердых частиц, например, углерода, так и от его температуры. Важнейшая характеристика топлива – это его теплотворная способность: Нефть -11000 ккал. на 1 кг. ; антрацит -8400 ккал. В качестве основного источника энергии в настоящее время используют химическую реакцию горения. 85 % всей энергии в нашей стране получают за счет сжигания топлива, в первую очередь ископаемых углей и вырабатывается на тепловых электростанциях. В автомобильном и авиационном транспорте в качестве источника энергии применяется реакция горения бензина – продукта переработки нефти (бензин – это смесь различных веществ, в состав которых входит углерод и водород). Сейчас широко используется атомная электроэнергия, в качестве ядерного горючего используется уран, обогащенный изотопом урана с атомной массой 237. Ответьте на вопросы:
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.26.104 (0.008 с.) |

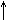 + 3H2
+ 3H2 


