
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалентные молярные массы окислителя и восстановителяСодержание книги
Поиск на нашем сайте ПРИМЕР 3.
-2ē
окислитель / Cu+2 +2ē ® Cu0 / восстановление восстановитель / Fe0 - 2ē ® Fe+2 / окисление Существует 3 типа окислительно-восстановительных реакций: межмолекулярные; внутримолекулярные; реакции диспропорционирования (самоокисления-самовосстановления). Межмолекулярные реакции протекают с изменением степени окисления атомов, которые находятся в различных молекулах. Т.е. окислитель и восстановитель находятся в разных веществах. Например: Cu0 + 4 HN+5O3 = Cu+2(NO3)2 + 2N+4O2 + 2H2O 2 Al + Fe2O3 C+ 4 HNO3(конц) = CO2 Внутримолекулярные реакции протекают с изменением степени окисления разных атомов в одной и той же молекуле. Т.е. окислитель и восстановитель входят в состав одной молекулы, например: 2NaCl+5O-23 = 2NaCl-1 + 3O20. 2 KNO3 4KMnO4 + 4KOH = 4K2MnO4 + O2 + 2H2O. В реакциях диспропорционирования атом (ион, молекула) одного и того же элемента является и окислителем, и восстановителем. Протекание таких реакций сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например: Cl20 + H2O = HCl+1O + HCl-1 Cl2 + 2 KOH 3NaClO → NaClO3 + 2NaCl .
1.2. ПОДБОР КОЭФФИЦИЕНТОВ В ОВР Для нахождения коэффициентов в ОВР применяют метод электронного баланса (метод электронных схем). Этот метод используется в реакциях, протекающих без участия воды. При уравнивании окислительно-восстановительных реакций методом электронного баланса необходимо знать, что: · Процессы окисления и восстановления являются взаимосвязанными процессами: невозможно окисление без восстановления и наоборот. · Число электронов, отданных одним атомом, равно числу электронов, принятых другим. · Число атомов и суммарный заряд должны быть одинаковы в правой и левой части. ПРИМЕР 4. Рассмотрим применение метода электронного баланса на примере окисления сульфата железа пермангатом калия в кислой среде. Для расстановки коэффициентов поступают следующим образом. 1) Записываем схему окислительно-восстановительной реакции и определяют элементы, изменившие степень окисления. KMn+7O4+ Fe+2SO4+ H2SO4 → Mn+2SO4 +Fe2+3(SO4)3+ K2SO4+ H2O 2) Записываем отдельно процессы окисления и восстановления, указывая при этом число отданных или принятых электронов. окислитель Mn+7 + 5ē → Mn+2 восстановление восстановитель 2Fe+2 - 2ē → 2Fe+3 окисление
3) Число отдаваемых и принимаемых электронов должно быть одинаковым. Общее число переданных электронов находим по правилу наименьшего общего кратного (НОК), а коэффициенты в полуреакциях окисления и восстановления - делением НОК на количество приобретенных и отданных электронов. При этом уравнения полуреакций принимают вид
5 2Fe+2 - 2ē → 2Fe+3 окисление
4) Складывая два уравнения с учетом найденных коэффициентов и производя его алгебраическое решение, получаем краткое ионное уравнение: 2 Mn+7 + 10Fe+2 → 2 Mn+2 + 10 Fe+3 5) Коэффициенты из краткого ионного уравнения переносим в полное молекулярное уравнение. 6) Подбором подводим баланс в левой и правой части уравнения. При этом атомы элементов справа и слева уравниваются по порядку: металлы, неметаллы, водород. 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
7) Для проверки правильности полученных коэффициентов необходимо посчитать количество атомов кислорода в левой и правой частях уравнения. Если их будет равное количество – коэффициенты подобраны верно.
ПРИМЕР 5. Расставим коэффициенты в реакции Ag + HNO3 → AgNO3 + NO + H2O методом электронного баланса. 1. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции. Найдем и подчеркнем элементы, изменившие степень окисления Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2 2. Составим электронный баланс. Для этого запишем полуреакции отдельно, указав, какой элемент и сколько теряет или принимает электронов (элементы, степень окисления которых не изменилась - в данном расчете не участвуют):
восст-тель / Ag0 - 1e = Ag+1 / окисление
3. Подбираем НОК, чтобы число принятых и отданных электронов было одинаковым. Делим НОК на количество переданных электронов, получаем коэффициенты к полуреакциям:
4.Составляем краткое ионное уравнение 3 Ag0 + N+5 = 3 Ag+1 + N+2 5. Коэффициенты из краткого ионного уравнения переносим в полное молекулярное уравнение, далее уравниваются атомы всех элементов в левой и правой части уравнения (металлы, н6еметаллы, водород): 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O 6.Проверяем равенство количества атомов кислорода слева и справа (12 = 9+1+2).
ПРИМЕР 6. Используя метод электронного баланса, рассавить коэффициенты в следующей ОВР: KN+3O2 + KMn+7O4 + H2O = KN+5O3 + Mn+4O2 + KOH
3 N+3– 2ē → N+5 - окисление _____________________________________ 2 Mn+7 +3 N+3 = 2 Mn+4 + 3 N+5 3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH
Другим способом нахождения коэффициентов в ОВР является метод электронно-ионного баланса (метод полуреакций). Он применяется при протекании ОВР в водных растворах. Его достоинством является то, что в данном случае применяются не гипотетические ионы, а реально существующие, не нужно знать степеней окисления атомов, и видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества: они появляются в уравнении реакции при выводе его. При составлении уравнений методом полуреакций следует учитывать следующие факторы: · восстановитель, окислитель и продукты их взаимодействия записывают в ионном виде, а затем уже приступают к составлению уравнений полуреакций. · Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и вещества, выпадающие в виде осадков - в виде молекул. · Продукты реакции (между восстановителем и окислителем) устанавливают опытным путем на основании известных свойств элементов по таблице полуреакций или по справочникам.
ПРИМЕР 7. Расставим коэффициенты в уравнении реакции: KMnO4 + Na2SO4 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O 1) Уравнение записываем в ионном виде: K++MnO4-+ 2Na++ SO32- + 2H+ + SO42- → Mn2++ SO42- + 2Na+ +SO42- +2K+ +SO42- +H2O 2) Процессы восстановления и окисления записываем в виде полуреакций:
5 SO32- + H2O – 2ē = SO42- + 2H+
3) Суммируя две полуреакции, получаем ионное уравнение: 2MnO4- + 16Н+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10Н+
4) Сокращая одинаковые частицы слева и справа: 2MnO4- + 6Н+ + 5SO32- = 2Mn2+ + 3H2O + 5SO42- 5) Коэффициенты из краткого ионного уравнения переносим в молекулярное. Правильность уравнения проверяем по балансу атомов кислорода. 2КMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4+ 5Na2SO4 + K2SO4 + 3Н2O ПРИМЕР 8. CrCI3 + NaCIO + NaOH → Na2CrO4 + NaCI + H2O
1) Записываем схему в ионной форме: Cr+3 + 3CI- + Na+ + CIO- + Na+ + OH- → 2Na+ + CrO2-4 + Na+ + CI- + H2O 2) Процессы восстановления и окисления записываем в виде полуреакций:
3 CIO- + H2O +2ê → CI- + 2OH- 3) Суммируя две полуреакции, получаем ионное уравнение:
2Cr+3 + 16OH- + 3H2O + 3CIO-→ 2CrO2-4 + 8H2O + 3CI- + 6OH- 4) Приводим подобные члены: 2Cr+3 + 10OH- + 3CIO- → 2CrO2-4 + 5H2O + 3CI- 5) Расставляем коэффициенты в молекулярном уравнении: 2CrCI3 + 3NaCIO + 10NaOH → 2Na2Cr2O7 + 3NaCI + 5H2O 6) Правильность уравнения проверяем по балансу атомов кислорода.
ПРИМЕР 9. Сu + HNO3 → Cu(NO3)2 +2NO + 4Н2О
ЗСu0 + 2 NO3- + 8Н+ = ЗСu2+ + 2NO + 4Н2О ЗСu + 8HNO3 = 3Cu(NO3)2 +2NO + 4Н2О В окислительно-восстановительных реакциях происходит обмен электронами между окислителем и восстановителем. В таких реакциях эквивалентом является та часть молекулярной массы окислителя или восстановителя, которая теряет (отдает) или приобретает (принимает) один электрон. Поэтому в ОВР молярные массы эквивалента (Мэкв) окислителя и восстановителя зависят от количества принятых или отданных электронов. Один и тот же окислитель (или восстановитель) может иметь несколько значений эквивалентной молярной массы в зависимости от того, какое количество электронов он принимает (или отдает в данной ОВР). В общем случае где М(ок-ля), М(в-ля) – молярные массы окислителя, восстановителя (г/моль); п – количество электронов, принятых окислителем или отданных восстановителем, в данной ОВР.
|
||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 52; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |


 +2ē
+2ē +2 0 0 +2
+2 0 0 +2
 CuSO4 + Fe = Cu + FeSO4
CuSO4 + Fe = Cu + FeSO4
 Al2O3 + 2 Fe,
Al2O3 + 2 Fe, + 4 NO2
+ 4 NO2  KCl + KClO + H2O,
KCl + KClO + H2O, 2 Mn+7 + 5ē → Mn+2 восстановление
2 Mn+7 + 5ē → Mn+2 восстановление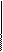 3 Ag0 - 1e = Ag+1 - окисление
3 Ag0 - 1e = Ag+1 - окисление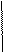 2 Mn+7 + 3ē → Mn+4 - восстановление
2 Mn+7 + 3ē → Mn+4 - восстановление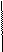 2 MnO4- + 8Н+ + 5ē = Mn2+ + 4H2O
2 MnO4- + 8Н+ + 5ē = Mn2+ + 4H2O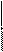
 2 Cr+3 + 8OH- -3ê → CrO2-4 + 4H2O
2 Cr+3 + 8OH- -3ê → CrO2-4 + 4H2O 3 Сu0 – 2ē = Сu2+ - окисление
3 Сu0 – 2ē = Сu2+ - окисление 2 NO3- + 4H+ + 3ē =NO + 2H2O - восстановление
2 NO3- + 4H+ + 3ē =NO + 2H2O - восстановление 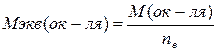 (1),
(1),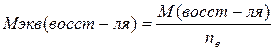 (2) ,
(2) ,


