Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Варианты самостоятельной работы студентовСодержание книги
Поиск на нашем сайте
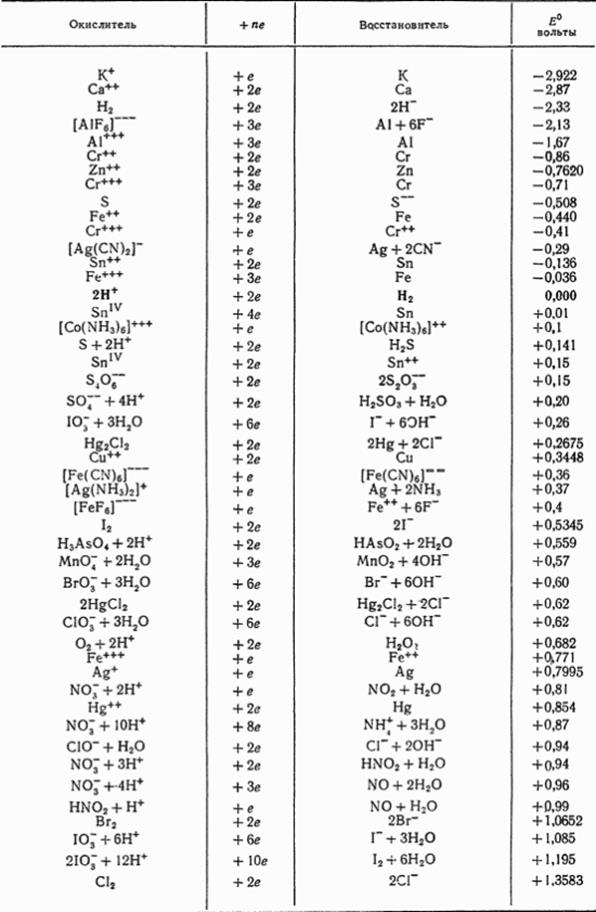
VII. Пользуясь значениями стандартных редокс-потенциалов (приложение 3), определить направление самопроизвольного протекания окислительно-восстановительной реакции при температуре 25°С. 116. KMnO4 + Na3AsO3 + H2SO4 ⇄ MnSO4 + Na3AsO4+ K2SO4 + H2O 117. KMnO4 + Na2SO3 + H2SO4 ⇄ MnSO4 + Na2SO4 + K2SO4 + H2O 118. K2Cr2O7 + SnSO4 + H2SO4 ⇄ Cr2(SO4)3 + Sn(SO4)2 +K2SO4 + H2O 119. KNO3 + K2MnO4 +H2O⇄KNO2 + KMnO4 + KOН 120. H2O2 + K4[Fe(CN)6] ⇄ K3[Fe(CN)6] + KOH 121. FeSO4 + K2Cr2O7 + H2SO4 ⇄ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O 122. NaCl + HNO3 + H2O ⇄ NH4NO3 + NaClO3 123. K2Cr2O7 + H2S + H2SO4 ⇄ Cr2(SO4)3 + S + K2SO4 + H2O 124. KNO3 + Fe(OH)2 + H2O ⇄ KNO2 + Fe(OH)3 125. KIO3 + KI + H2SO4 ⇄ I2 + K2SO4 + H2O 126. MnO2 +Na2SO3 +H2SO4 ⇄MnSO4 + Na2SO4 + H2O 127. Mn(NO3)2 + PbO2 + HNO3 ⇄ HMnO4 + Pb(NO3)2 + H2O 128. H2O2 + KI ⇄ I2 + KOH 129. SnSO4 +MnO2 +H2SO4⇄Sn(SO4)2 +MnSO4 + H2O 130. KMnO4 +FeSO4 +H2SO4 ⇄MnSO4 +Fe2(SO4)3 + K2SO4 + H2O
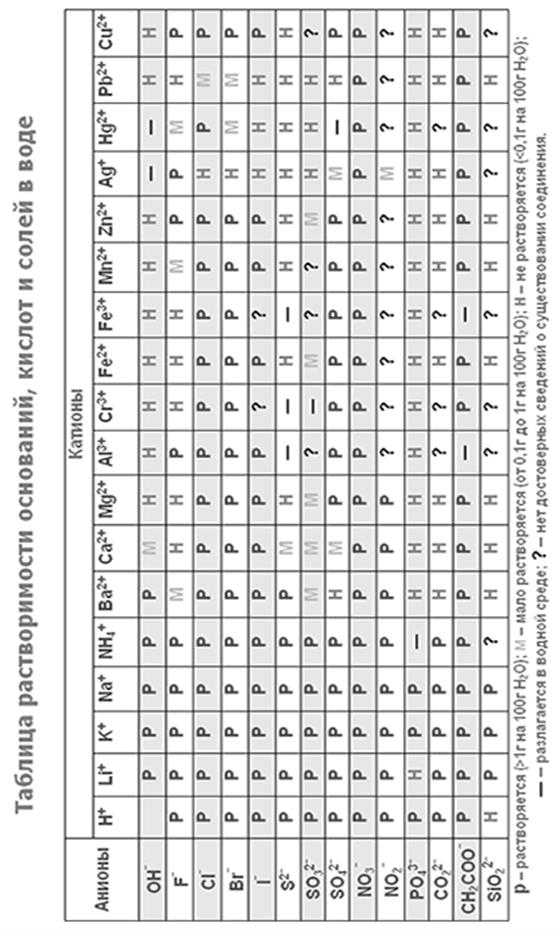
Варианты самостоятельной работы студентов вариант Номера заданий 1 Приложение 1
Приложение 2
Приложение 3
ЛИТЕРАТУРА 1. Егоров В.В. Теоретические основы неорганической химии. М.: Лань. 2010. 192 с. 2. Г.П. Хомченко , И.К. Цитович. Неорганическая химия. М.: Высшая школа, 2011. 464 с. 3. Д.К. Князев, С.Н. Смарыгин. Неорганическая химия. М.: Дрофа, 2008. 591с. 4. В.В.Вольхин. Общая химия. Основной курс. СПб.: Лань. 2008. 464 с. 5. Неорганическая химия. Под ред. Ю.Д. Третьякова. В 3- томах. М.: Академия, 2009. 6. Хаускрофт К., Констебл Э. Современный курс общей химии. М.; Мир, 2011. СОДЕРЖАНИЕ СТР. 1.1. Основные сведения. 1.2. ПОДБОР КОЭФФИЦИЕНТОВ В ОВР 1.3. Эквивалентные молярные массы окислителя и восстановителя
1.4. ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ. УРАВНЕНИЕ НЕРНСТА 1.5. НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ОВР
1.6. ИЗМЕРЕНИЕ РЕДОКС-ПОТЕНЦИАЛА
1.7. ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ. Потенциалы в клетках и почвах
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Задания для самостоятельного решения
Варианты самостоятельной работы студентов ПРИЛОЖЕНИЯ ЛИТЕРАТУРА СОДЕРЖАНИЕ
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 5; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.252.215 (0.009 с.) |