
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопросы и упражнения для самостоятельнойСодержание книги
Поиск на нашем сайте
Вариант № 3 1. Под каким номером приведено уравнение окислительно-восстановительной реакции? 1) H2SO4 + Mg → MgSO4 + H2, 2) CuSO4 + 2NaOH →Cu(OH)2 + Na2SO4, 3) SO3 + K2O → K2SO4, 4) CO2 + H2O → H2CO3, 5) H2SO4 + 2KOH → K2SO4 + 2H2O. 2. Руководствуясь строением атома, определите, под каким номером приведена формула иона, который может быть восстановителем: 1) Ag+, 2) Al3+, 3) Cl7+, 4) Sn2+, 5) Zn2+? 3. Под каким номером приведен процесс восстановления? 1) NO2– → NO3–, 2) S2– → S0, 3) Mn2+ → MnO2, 4) 2I– → I2, 5) 4. Под каким номером приведена масса прореагировавшего железа, если в результате реакции, представленной следующей схемой: Fe + HNO3 → Fe(NO3)3 + NO + H2O образовалось 11,2 л NO (н.у.)? 1) 2,8, 2) 7, 3) 14, 4) 56, 5) 28. 5. Под каким номером приведена схема реакции самоокисления-самовосстановления (дисмутации)? 1) HI + H2SO4 → I2 + H2S + H2O, 2) FeCl2 + SnCl4 → FeCl3 + SnCl2, 3) HNO2 → NO + NO2 + H2O, 4) KClO3 → KCl + O2, 5) Hg(NO3)2 → HgO + NO2 + O2.
Ответы на задания тестов см. на стр. 10.3. Вопросы и упражнения для самостоятельной работы по изучению темы.
1. Укажите номер или сумму условных номеров, под которыми расположены схемы окислительно-восстановительных реакций: 1) MgCO3 + HCl ® MgCl2 + CO2 + H2O, 2) FeO + P ® Fe + P2O5, 4) H2O2 ® H2O + O2, 8) KOH + CO2 ® KHCO3. 2. Укажите номер или сумму условных номеров, под которыми расположены окислительно-восстановительные процессы: 1) электролиз раствора хлорида натрия, 2) обжиг пирита, 3) гидролиз раствора карбоната натрия, 4) гашение извести. 3. Укажите номер или сумму условных номеров, под которыми расположены названия групп веществ, характеризующихся возрастанием окислительных свойств: 1) хлор, бром, фтор, 2) углерод, азот кислород, 3) водород, сера, кислород, 4) бром, фтор, хлор. 4. Какое из веществ – хлор, сера, алюминий, кислород – является более сильным восстановителем? В ответе укажите значение молярной массы выбранного соединения. 5. Укажите номер или сумму условных номеров, под которыми расположены только окислители: 1) K2MnO4, 2) KMnO4, 4) MnO3 , 8) MnO2, 16) K2Cr2O7, 32) K2SO3. 6. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, обладающих окислительно-восстановительной двойственностью: 1) KI, 2) H2O2, 4) Al, 8) SO2, 16) K2Cr2O7, 32) H2. 7. Какое из соединений – оксид железа (III), оксид хрома (III), оксид серы (IV), оксид азота (II), оксид азота (V) – может быть только окислителем? В ответе укажите значение молярной массы выбранного соединения. 8. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые имеют степень окисления кислорода – 2: 1) H2O, Na2O, Cl2O, 2) HPO3, Fe2O3, SO3, 4) OF2, Ba(OH)2, Al2O3, 8) BaO2, Fe3O4, SiO2. 9. Какое из указанных соединений может быть только окислителем: нитрит натрия, сернистая кислота, сероводород, азотная кислота? В ответе укажите значение молярной массу выбранного соединения. 10. Какое из приведенных соединений азота – NH3; HNO3; HNO2; NO2 – может быть только окислителем? В ответе запишите значение относительной молекулярной массы выбранного соединения. 11. Под каким номером, среди перечисленных ниже названий веществ, указан наиболее сильный окислитель? 1) концентрированная азотная кислота, 2) кислород, 3) электрический ток на аноде при электролизе, 4) фтор. 12. Какое из приведенных соединений азота – HNO3; NH3; HNO2; NO – может быть только восстановителем? В ответе запишите значение молярной массы выбранного соединения. 13. Какое из соединений – Na2S; K2Cr2O7; KMnO4; NaNO2; KClO4 – может быть и окислителем и восстановителем, в зависимости от условий протекания реакции? В ответе запишите значение молярной массы выбранного соединения. 14. Укажите номер или сумму условных номеров, где указаны ионы, которые могут быть восстановителями: 1) (MnO4)2–, 2) (CrO4) –2, 4) Fe+2, 8) Sn+4, 16) (ClO4) –. 15. Укажите номер или сумму условных номеров, под которым расположены только окислители: 1) K2MnO4, 2) HNO3, 4) MnO3, 8) MnO2, 16) K2CrO4, 32) H2O2. 16. Укажите номер или сумму условных номеров, под которыми расположены только названия веществ, между которыми не возможно протекание окислительно-восстановительных реакций: 1) углерод и серная кислота, 2) серная кислота и сульфат натрия, 4) сероводород и иодоводород, 8) оксид серы (IV) и сероводород. 17. Укажите номер или сумму условных номеров, под которыми расположены процессы окисления: 1) S+6 ® S–2, 2) Mn+2 ® Mn+7, 4) S–2 ® S+4, 8) Mn+6 ® Mn+4, 16) О2 ® 2О–2, 32) S+4 ® S+6. 18. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления: 1) 2I–1 ® I2, 2) 2N+3 ® N2, 4) S–2 ® S+4, 8) Mn+6 ® Mn+2, 16) Fe+3 ® Fe0, 32) S0 ® S+6. 19. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления: 1) С0 ® CО2, 2) Fe+2 ® Fe+3, 4) (SO3)2– ® (SO4)2–, 8) MnO2 ® Mn+2. 20. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления: 1) Mn+2 ® MnO2, 2) (IO3) – ® (IO4) –, 4) (NO2) – ® (NO3) –, 8) MnO2 ® Mn+2. 21. Укажите номер или сумму условных номеров, под которыми расположены ионы, являющиеся восстановителями. 1) Ca+2, 2) Al+3, 4) K+, 8) S–2, 16) Zn+2, 32) (SO3)2–. 22. Под каким номером приведена формула вещества, при взаимодействии с которым водород выполняет роль окислителя? 1) O2, 2) Na, 3) S, 4) FeO. 23. Под каким номером приведено уравнение реакции, в которой проявляются восстановительные свойства хлорид-иона? 1) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2О, 2) CuO + 2HCl = CuCl2 + H2O, 3) Zn + 2HCl = ZnCl2 + H2, 4) AgNO3 + HCl = AgCl + HNO3. 24. При взаимодействии с каким из указанных веществ – O2, NaOH, H2S – оксид серы (IV) проявляет свойства окислителя? Напишите уравнение соответствующей реакции и в ответе укажите сумму коэффициентов у исходных веществ. 25. Укажите номер или сумму условных номеров, под которыми расположены схемы реакций диспропорционирования: 1) NH4NO3 ® N2O + H2O, 2) NH4NO2 ® N2 + H2O, 4) KClO3 ® KClO4 + KCl, 8) KClO3 ® KCl + O2. 26. Составьте схему электронного баланса и укажите, какое количество вещества перманганата калия участвует в реакции c десятью моль оксида серы (IV). Реакция протекает по схеме: KMnO4 + SO2 ® MnSO4 + K2SO4 + SO3. 27. Составьте схему электронного баланса и укажите, какое количество вещества сульфида калия взаимодействует с шестью моль перманганата калия в реакции: K2S + KMnO4 + H2O ® MnO2 + S + KOH. 28. Составьте схему электронного баланса и укажите, какое количество вещества перманганата калия взаимодействует с десятью молями сульфата железа (II) в реакции: KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O. 29. Составьте схему электронного баланса и укажите, какое количество вещества хромита калия (KCrO2) взаимодействует с шестью моль брома в реакции: KCrO2 + Br2 + KOH ® K2CrO4 + KBr + H2O. 30. Составьте схему электронного баланса и укажите, какое количество вещества оксида марганца (IV) взаимодействует с шестью моль оксида свинца (IV) в реакции: MnO2 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + H2O. 31. Составьте уравнение реакции: KMnO4 + NaI + H2SO4 ® I2 + K2SO4 + MnSO4 + Na2SO4 + H2O. В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции. 32. Составьте уравнение реакции: KMnO4 + NaNO2 + H2O ® MnO2 + NaNO3 + KOH. В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции. 33. Составьте уравнение реакции: K2Cr2O7 + HClконц. ® KCl + CrCl3 + Cl2 + H2O. В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции. 34. Составьте схему электронного баланса и укажите, какое количество вещества нитрита натрия (NaNO2) взаимодействует с четырьмя моль перманганата калия в реакции: KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O. 35. Составьте схему электронного баланса и укажите, какое количество вещества сероводорода взаимодействуют с шестью моль перманганата калия в реакции: KMnO4 + H2S + H2SO4 ® S + MnSO4 + K2SO4 + H2O. 36. Какое количество вещества железа в молях окислится кислородом объемом 33,6 л (н.у.) в реакции, протекающей по нижеприведенной схеме? Fe + H2O + O2 ® Fe(OH)3. 37. Какой из приведенных металлов – Zn, Rb, Ag, Fe, Mg – не растворяется в разбавленной серной кислоте? В ответе укажите значение относительной атомной массы этого металла. 38. Какой из приведенных металлов – Zn, Rb, Ag, Fe, Mg – не растворяется в концентрированной серной кислоте? В ответе укажите порядковый номер элемента в периодической системе Д.И. Менделеева. 39. Укажите номер или сумму условных номеров, под которыми расположены металлы, пассивирующиеся в концентрированных растворах кислот-окислителей. 1) Zn, 2) Cu, 4) Au, 8) Fe, 16) Mg, 32) Cr. 40. Укажите номер или сумму условных номеров, под которыми расположены химические знаки металлов, не вытесняющих водород из разбавленного раствора серной кислоты, но вытесняющих ртуть из растворов солей Hg2+: 1) Fe, 2) Zn, 4) Au, 8) Ag, 16) Cu. 41. Под каким номером указаны химические знаки металлов, каждый из которых не реагируют с азотной кислотой? 1) Zn, Ag; 2) Pt, Au; 3) Cu, Zn; 4) Ag, Hg. 42. Под каким номером указан способ получения хлора в промышленности? 1) электролизом раствора хлорида натрия; 2) действием оксида марганца (1V) на соляную кислоту; 3) термическим разложением природных соединений хлора; 4) действием фтора на хлориды. 43. Под каким номером расположена химическая формула газа, преимущественно выделяющегося при действии концентрированного раствора азотной кислоты на медь? 1) N2, 2) NO2, 3) NO, 4) H2. 44. Под каким номером указаны формулы продуктов реакции горения сероводорода на воздухе при недостатке кислорода? 1) SO2 + H2O, 2) S + H2O, 3) SO3 + H2O, 4) SO2 + H2. Укажите номер правильного ответа. 45. Составьте уравнение реакции взаимодействия концентрированной серной кислоты с медью. В ответе укажите сумму коэффициентов в уравнении реакции.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 5; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.139.55 (0.009 с.) |

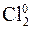 → 2Cl–.
→ 2Cl–.


