
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Степень окисления металлов в соединениях обычно положительная величина.Содержание книги
Поиск на нашем сайте
4. Степень окисления металлов в соединениях обычно положительная величина. Например: +2 СuSO4. 5. Степень окисления неметаллов может быть и отрицательной, и положительной. Например: –1 +1 HCl, HClO. 6. Сумма cтепеней окисления всех атомов в молекуле равна нулю. Окислительно-восстановительные реакции представляют собой два взаимосвязанных процесса – процесса окисления и процесса восстановления. Процесс окисления – это процесс отдачи электронов атомом, молекулой или ионом; при этом степень окисления увеличивается, а вещество является восстановителем:
Fe+2 – ē ® Fe+3 процесс окисления, 2J– – 2ē ® Процесс восстановления – это процесс присоединения электронов, при этом степень окисления уменьшается, а вещество является окислителем:
Mn+7 + 5ē ® Mn+2 процесс восстановления, Cu+2 +2ē ® Cu0 процесс восстановления. Окислитель – вещество, которое принимает электроны и при этом восстанавливается (степень окисления элемента понижается). Восстановитель – вещество, которое отдает электроны и при этом окисляется (степень окисления элемента понижается). Сделать обоснованное заключение о характере поведения вещества в конкретных окислительно-восстановительных реакциях можно на основании значения окислительно-восстановительного потенциала, который рассчитывается по величине стандартного окислительно-восстановительного потенциала. Однако, в ряде случаев, можно, не прибегая к расчетам, а зная общие закономерности, определить, какое вещество будет являться окислителем, а какое - восстановителем, и сделать заключение о характере протекания окислительно - восстановительной реакции. Типичными восстановителями являются: · некоторые простые вещества: металлы: например, Na, Mg, Zn, Al, Fe, неметаллы: например, H2, C, S; · некоторые сложные вещества: например, сероводород (H2S) и сульфиды (Na2S), сульфиты (Na2SO3), оксид углерода (II) (CO), галогеноводороды (HJ, HBr, HCI) и соли галогеноводородных кислот (KI, NaBr), аммиак (NH3); · катионы металлов в низших степенях окисления: например, SnCl2, FeCl2, MnSO4, Cr2(SO4)3; · катод при электролизе. Типичными окислителями являются: · некоторые простые вещества – неметаллы: например,галогены (F2, CI2, Br2, I2), халькогены (О2, О3, S); · некоторые сложные вещества: например, азотная кислота (HNO3),серная кислота (H2SO4 конц.), прерманганат калия (K2MnO4), бихромат калия (K2Cr2O7), хромат калия (K2CrO4), оксид марганца (IV) (MnO2), оксид свинца (IV) (PbO2), хлорат калия (KCIO3), пероксид водорода (H2O2); · анод при электролизе. При составлении уравнений окислительно-восстановительных реакций следует иметь в виду, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Существуют два метода составления уравнений окислительно-восстановительных реакций – метод электронного баланса и электронно-ионный метод (метод полуреакций). При составлении уравнений окислительно-восстановительных реакций методом электронного баланса следует придерживаться определенного порядка действий. Рассмотрим порядок составления уравнений этим методом на примере реакции между перманганатом калия и сульфитом натрия в кислой среде. 1) Записываем схему реакции (указываем реагенты и продукты реакции): KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O. 2) Определяем степени окисления у атомов элементов, изменяющих ее величину: +7 + 4 + 2 + 6 KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O. 3) Составляем схему электронного баланса. Для этого записываем химические знаки элементов, атомы которых изменяют степень окисления, и определяем, сколько электронов отдают или присоединяют соответствующие атомы или ионы. Указываем процессы окисления и восстановления, окислитель и восстановитель. Уравниваем количество отданных и принятых электронов и, таким образом, определяем коэффициенты при восстановителе и окислителе (в данном случае они соответственно равны 5 и 2):
2 Mn+7 + 5 e- → Mn+2 процесс восстановления, окислитель. 4) Далее остальные элементы уравниваем обычным путем и заменяем стрелку в схеме на знак равенства в уравнении реакции: 2KMnO4 +5Na2SO3 + 8H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O. 5) Если водород и кислород не меняет своих степеней окисления, то их количество подсчитывают в последнюю очередь и добавляют нужное количество молекул воды в левую или правую часть уравнения. Окислительно-восстановительные реакции подразделяются на три типа: межмолекулярные, внутримолекулярные и реакции самоокисления – самовосстановления (диспропорционирования). Реакциями межмолекулярного окисления – восстановления называются окислительно-восстановительные реакции, окислитель и восстановитель в которых представлены молекулами разных веществ. Например: 0 +3 0 +3 2Al + Fe2O3 = 2Fe + Al2O3, Al0 – 3e– → Al+3 окисление, восстановитель, Fe+3 +3e– → Fe0 восстановление, окислитель. В этой реакции восстановитель (Al) и окислитель (Fe+3) входят в состав различных молекул. Реакциями внутримолекулярного окисления – восстановления называются реакции, в которых окислитель и восстановитель входят в состав одной молекулы (и представлены либо разными элементами, либо одним элементом, но с разными степенями окисления): +5 –1 0 2 KClO3 = KCl + 3O2
3 2O–2 – 4е– → В этой реакции восстановитель (O–2) и окислитель (CI+5) входят в состав одной молекулы и представлены различными элементами. В реакции термического разложения нитрита аммония меняют свои степени окисления атомы одного и того же химического элемента – азота, входящие в состав одной молекулы: -3 +3 0 NH4NO2 = N2 + 2H2O N–3 – 3e– → N0 восстановление, окислитель N+3 + 3e– → N0 окисление, восстановитель. Реакции подобного типа часто называют реакциями контрпропорционирования.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 5; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.101.151 (0.007 с.) |

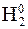 – 2ē ® 2H+ процесс окисления,
– 2ē ® 2H+ процесс окисления,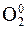 + 4ē ® 2O–2 процесс восстановления,
+ 4ē ® 2O–2 процесс восстановления, 5 S+4 – 2 e- → S+6 процесс окисления, восстановитель
5 S+4 – 2 e- → S+6 процесс окисления, восстановитель 2 CI+5 + 6e– → CI–1 восстановление, окислитель
2 CI+5 + 6e– → CI–1 восстановление, окислитель


