
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные реакции.Содержание книги
Поиск на нашем сайте
Глава 10 Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав молекул реагирующих веществ: 0 0 +2 -2 2Mg + O2 ® 2MgO, +5 -2 -1 0 2KClO3 Напомним, что степень окисления – это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные. Степень окисления – формальное понятие; в ряде случаев значение степени окисления элемента не совпадает с его валентностью. Для нахождения степени окисления атомов элементов, входящих в состав реагирующих веществ, следует иметь в виду следующие правила: 1. Степень окисления атомов элементов в молекулах простых веществ равна нулю. Например:
2. Степень окисления атомов водорода в соединениях обычно равна +1. Например: +1 +1 HCl, H2S Исключения: в гидридах (соединениях водорода с металлами) cтепень окисления атомов водорода равна –1. Например:
3. Степень окисления атомов кислорода в соединениях обычно равна –2. Например: Н2О–2, СаО–2. Исключения: · степень окисления кислорода во фториде кислорода (OF2) равна +2. · степень окисления кислорода в пероксидах (Н2О2, Na2O2), содержащих группу –O–O–, равна –1.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.174.65 (0.005 с.) |

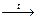 2KCl + 3O2.
2KCl + 3O2.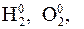 Mg0, Cu0.
Mg0, Cu0.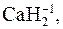 NaH–1.
NaH–1.


