
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопросы для самоконтроля по темеСодержание книги
Поиск на нашем сайте
Реакции самоокисления – самовосстановления (диспропорционирования) – это реакции, при протекании которых один и тот же элемент с одной и той же степенью окисления сам и повышает, и понижает свою степень окисления. Например: 0 -1 +1 Cl2 + H2O = HCI + HCIO CI0 + 1e– → CI–1 восстановление, окислитель CI0 – 1e– → CI+1 окисление, восстановитель. Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления. Свойства простых веществ могут прогнозироваться по положению атомов их элементов в периодической системе элементов Д.И. Менделеева. Так, все металлы в окислительно-восстановительных реакциях будут являться восстановителями. Катионы металлов могут быть и окислителями. Неметаллы в виде простых веществ могут быть как окислителями, так и восстановителями (исключая фтор и инертные газы). Окислительная способность неметаллов усиливается в периоде слева направо, а в группе – снизу вверх. Восстановительные способности, наоборот, уменьшаются слева направо и снизу вверх как для металлов, так и для неметаллов. Если окислительно-восстановительная реакция металлов происходит в растворе, то для определения восстановительной способности используют ряд стандартных электродных потенциалов (ряд активности металлов). В этом ряду металлы расположены по мере убывания восстановительной способности их атомов и возрастания окислительной способности их катионов (см. табл. 9 приложения). Наиболее активные металлы, стоящие в ряду стандартных электродных потенциалов до магния, могут реагировать с водой, вытесняя из нее водород. Например: Ca + 2H2O = Ca(OH)2 + H2 ↑ При взаимодействии металлов с растворами солей следует иметь в виду, что каждый более активный металл (не взаимодействующий с водой) способен вытеснять (восстанавливать) стоящий за ним металл из раствора его соли. Так, атомы железа могут восстановить катионы меди из раствора сульфата меди (CuSO4): Fe + CuSO4 = Cu + FeSO4 Fe0 – 2e– = Fe+2 окисление, восстановитель Cu+2 + 2e– = Cu0 восстановление, окислитель. В этой реакции железо (Fe) расположено в ряду активности до меди (Cu) и является более активным восстановителем. Реакция, например, серебра с раствором хлорида цинка будет невозможна, так как серебро расположено в ряду стандартных электродных потенциалов правее цинка и является менее активным восстановителем. Ag + ZnCl2 ≠ Все металлы, которые стоят в ряду активности до водорода, могут вытеснять водород из растворов обычных кислот, то есть восстанавливать его: Zn + 2HCl = ZnCI2 + H2↑ Zn0 – 2e– = Zn+2 окисление, восстановитель 2H+ + 2e– → Металлы, которые стоят в ряду активности после водорода, не будут восстанавливать водород из растворов обычных кислот. Cu + HCI ≠ Чтобы определить, может ли быть окислителем или восстановителем сложное вещество, необходимо найти степень окисления элементов, его составляющих. Элементы, находящиеся в высшей степени окисления, могут ее только понижать, принимая электроны. Следовательно, вещества, молекулы которых содержат атомы элементов в высшей степени окисления, будут только окислителями. Например, HNO3, KMnO4, H2SO4 в окислительно-восстановитель-ных реакциях будут выполнять функцию только окислителя. Степени окисления азота (N+5), марганца (Mn+7) и серы (S+6) в этих соединениях имеют максимальные значения (совпадают с номером группы данного элемента). Если элементы в соединениях имеет низшую степень окисления, то они могут ее только повышать, отдавая электроны. При этом такие вещества, содержащие элементы в низшей степени окисления, будут выполнять функцию только восстановителя. Например, аммиак, сероводород и хлороводород (NH3, H2S, НCI) будут только восстановителями, так как степени окисления азота (N–3), серы (S–2) и хлора (Cl–1) являются для этих элементов низшими. Вещества, в состав которых входят элементы, имеющие промежуточные степени окисления, могут быть как окислителями, так и восстановителями, в зависимости от конкретной реакции. Таким образом, они могут проявлять окислительно-восстановительную двойственность. К таким веществам относятся, например, пероксид водорода (H2O2), водный раствор оксида серы (IV) (сернистая кислота), сульфиты и др. Подобные вещества, в зависимости от условий среды и наличия более сильных окислителей (восстановителей) могут проявлять в одних случаях окислительные свойства, а в других - восстановительные. Как известно, многие элементы имеют переменную степень окисления, входя в состав различных соединений. Например, сера в соединениях H2S, H2SO3, H2SО4 и сера S в свободном состоянии имеет соответственно степени окисления –2, +4, +6 и 0. Сера относится к элементам р-электронного семейства, ее валентные электроны расположены на последнем s- и р-подуровнях (...3s3р). У атома серы со степенью окисления – 2 валентные подуровни полностью укомплектованы. Поэтому, атом серы с минимальной степенью окисления (–2) может только отдавать электроны (окисляться) и быть только восстановителем. Атом серы со степенью окисления +6 потерял все свои валентные электроны и в данном состоянии может только принимать электроны (восстанавливаться). Поэтому атом серы с максимальной степенью окисления (+6) может быть только окислителем. Атомы серы с промежуточными степенями окисления (0, +4) могут и терять и присоединять электроны, то есть быть как восстановителями, так и окислителями. Аналогичные рассуждения правомочны при рассмотрении окислительно-восстановительных свойств атомов других элементов. На характер протекания окислительно-восстановительной реакции влияет концентрация веществ, среда раствора и сила окислителя и восстановителя. Так, концентрированная и разбавленная азотная кислота по-разному реагирует с активными и малоактивными металлами. Глубина восстановления азота (N+5) азотной кислоты (окислителя) будет определяться активностью металла (восстановителя) и концентрацией (разбавлением) кислоты. 4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O, 8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O, 10HNO3(конц.) + 4Мg = 4Mg(NO3)2 + N2O + 5H2O, 10HNO3(c. разб.) + 4Мg = 4Mg(NO3)2 + NH4NO3 + 3H2O. Существенное влияние на протекание окислительно-восстановительных процессов оказывает реакция среды. Если в качестве окислителя используют перманганат калия (KMnO4), то в зависимости от реакции среды раствора, Mn+7 будет восстанавливаться по-разному: в кислой среде (до Mn+2) продуктом восстановления будет соль, например, MnSO4, в нейтральной среде (до Mn+4) продуктом восстановления будет MnO2 или MnO(OH)2, в щелочной среде (до Mn+6) продуктом восстановления будет манганат, например, К2MnO4. Например, при восстановлении раствора перманганата калия сульфитом натрия, в зависимости от реакции среды, будут получаться соответствующие продукты: кислая среда – 2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 +H2O нейтральная среда – 2KMnO4 + 3Na2SО3 + H2O = 3Na2SO4 + 2MnO2 + 2KOH щелочная среда – 2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + Na2MnO4 + K2MnO4 + H2O. Температура системы также влияет на ход окислительно-восстановительной реакции. Так, продукты взаимодействия хлора с раствором щелочи будут различны в зависимости от температурных условий. При взаимодействии хлора с холодным раствором щелочи реакция идет с образованием хлорида и гипохлорита: 0 -1 +1 Cl2 + KOH → KCI + KCIO + H2O CI0 + 1e– → CI–1 восстановление, окислитель CI0 – 1e– → CI+1 окисление, восстановитель. Если взять горячий концентрированный раствор КОН, то в результате взаимодействия с хлором получим хлорид и хлорат: 0 t° -1 +5 3CI2 + 6KOH → 5KCI + KCIO3 + 3H2O 5 │ CI0 + 1e– → CI–1 восстановление, окислитель 1 │ CI0 – 5e– → CI+5 окисление, восстановитель.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 5; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.217.242 (0.008 с.) |

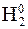 восстановление, окислитель.
восстановление, окислитель.


