Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Курс лекций по генетической инженерииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
КАЗАНСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ М.Р.ШАРИПОВА КУРС ЛЕКЦИЙ ПО ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ Учебное пособие Казань 2015 Печатается по решению Учебно-методической комиссии Института Фундаментальной Медицины и Биологии КФУ Протокол № 1 от 9.09.14
УДК 579.6 ББК28.4 Автор: д.б.н., проф. М.Р.Шарипова
Рецензенты: Д.б.н., проф. кафедры биохимии и биотехнологии К(П)ФУ Т.В.Багаева К.б.н., доцент каф.микробиологии Казанской государственной медицинской академии Л.В.Кипенская Курс лекций по генетической инженерии: учебное пособие / М.Р.Шарипова. – Казань: К(П)ФУ, 2015. -114с.
Учебное пособие основано на материале, который используется для чтения курса лекций по генетической инженерии студентам, обучающимся по биологическим специальностям. Изложены стратегия молекулярного клонирования, типы молекулярных векторов, современные методы получения рекомбинантных ДНК, амплификации и секвенирования. Большое внимание уделено практическому применению достижений генной инженерии для получения лекарственных средств, вакцин, инсектицидов, генной терапии, получению трансгенных растений и животных. Учебное пособие может использоваться в учебном процессе, а также быть полезным для тех, кто хочет специализироваться в области генной инженерии.
© Шарипова М.Р., 2015 Содержание
Введение Генная инженерия относится к новому разделу экспериментальной молекулярной биологии и направлена на конструирование in vitro функционально-активных генетических структур - рекомбинантных ДНК. Появление новой методологии расширило экспериментальные границы молекулярной биологии, поскольку позволило манипулировать с чужеродной ДНК и исследовать ее функционирование в гетерологичных системах. Такой подход обогатил теорию знаниями о закономерностях механизма передачи генетической информации и послужил основой для создания принципиально новых биотехнологий. По сути, генно-инженерные методы совершили революцию в биологической науке. Цель генной инженерии – выяснение механизмов функционирования генетического аппарата. Практические задачи - создание генно-инженерных штаммов бактерий для получения лекарственных средств, диагностикумов, вакцин; создание трансгенных растений с заданными свойствами; создание трансгенных животных для практических целей; разработка методов генной терапии человека. Фундаментом для развития генной инженерии служат достижения в молекулярной биологии, микробиологии, биохимии и генетике. Достижения в этих базисных областях науки позволили изолировать дискретные участки ДНК – гены. До создания методологии рекомбинантных ДНК все рассуждения о природе гена, генетическом коде были теоретическими. Можно было выделить ДНК практически из любых организмов, но невозможно было выделить отдельный ген. Гены идентифицировали наблюдением за корреляцией специфических мутаций (наблюдение фенотипа). Технология получения рекомбинантной ДНК позволила впервые в практике научных исследований выделить из организма индивидуальный ген. Это стало точкой отсчета для развития науки генной инженерии. Почему изолировать ген так важно? Выделение гена дает возможность исследовать его структуру, выяснить закономерности организации и строения, сравнить с другими генами и определить последовательность аминокислот белка, который этот ген кодирует. Знание белкового продукта позволяет сделать заключение о функции гена. И, наконец, знание структуры гена дает возможность его целенаправленной модификации. Теоретические предпосылки для генной инженерии: 1. К началу развития науки генной инженерии был установлен механизм информационного взаимодействия между основными макромолекулами, участвующими в передаче наследственной информации от одного организма другому. Это – репликация, матричный синтез ДНК, при котором цепочка ДНК расплетается, и на каждой образуются новые, комплиментарные. По такому же механизму на ДНК синтезируются комплиментарные ей РНК – транскрипция. На матрице РНК на рибосомах осуществляется синтез белка, структура которого соответствует структуре мРНК – трансляция. 2. Следующий шаг на пути к генной инженерии – открытие внехромосомной самореплицирующейся ДНК или мини-хромосом, которые получили название плазмиды. 3. Выделение и получение ферментов рестриктаз, которые специфически расщепляют ДНК, позволило манипулировать с фрагментами ДНК и привело к возможности изолировать индивидуальный ген. Приемы генной инженерии позволяют проводить рекомбинацию ДНК in vitro и только затем вводить целевую конструкцию в клетку, где происходит экспрессия гена. История молекулярного клонирования начинается в 1972 г, когда впервые in vitro была получена рекомбинантная молекула ДНК из фрагментов разных ДНК. Вирусная ДНК SV40 и ДНК фага лямбда были объединены в лаборатории П.Берга (Станфордский университет, США). В 1973 г. Коэн и Бойер использовали для получения рекомбинантной ДНК плазмидную ДНК и получили первую гибридную плазмиду, которую можно ввести в бактериальные клетки и получить экспрессию чужеродной ДНК in vivo. Стало очевидным, что новый метод открывает неограниченные возможности. Далее следует 35-летняя истории развития науки о молекулярном клонировании. В итоге, осуществлен прорыв в понимании структуры гена, получены качественно новые знания об организации наследственной информации. К ним можно отнести открытие мозаичного строения генов эукариот в отличие от генов прокариот, идентификацию мобильных элементов, разработку информационных технологий, создание мировых баз данных для анализа и сравнения генов. Более того, появилась возможность искусственно создавать гены, кодирующие химерные полипептиды, обладающие свойствами двух или более природных белков. Впечатляющие успехи генной инженерии в практических достижениях. Данный подход открыл перспективы создания принципиально новых микробных продуцентов биологически активных веществ, а также животных и растений, несущих функционально активные чужеродные гены. Типы молекулярных векторов В зависимости от поставленной задачи исследователи используют разные типы молекулярных векторов. Векторы-амплификаторы способны амплифицировать (размножаться) до 1-3 тыс. копий на клетку. Число копий плазмид, находящихся под ослабленным контролем, составляет 100-200 копий на клетку. Это число может увеличиться до нескольких тысяч копий на клетку, если подавить синтез белков хозяина, обработав клетки бактерий хлорамфениколом. Хлорамфеникол связывается с большой рибосомной субъдиницей и ингибирует образование пептидной связи, т.е. ингибирует пептидил-трансферазу. В этих условиях репликация плазмид под ослабленным контролем продолжается, а репликация хромосомной ДНК и плазмид, находящихся под строгим контролем, прекращается. Плазмиды, способные амплифицировать при глобальной блокаде синтеза белка, не обнаружены у бацилл. Векторы экспрессии – это векторы, которые содержат регуляторные элементы для эффективной транскрипции и трансляции клонированных генов. Для эффективной транскрипции нужны сильные промоторы. Все природные промоторы E. coli имеют консенсусы в –10 (бокс Прибнова) и –35 областях от сайта инициации транскрипции. По частоте встречаемости нуклеотидов в каждой из позиций были построены оптимальные –10 и –35 последовательности: -10 (ТАТААТ) и –35 (ТТGACA). Многие гены E. coli контролируются относительно слабыми промоторами, характеризующимися низкой гомологией к консенсусным. Чем больше различия между ними, тем слабее промотор. Вектор экспрессии должен иметь сильный промотор, к ним относятся следующие: lac-промотор (Plac) - промотор lac-оперона; trp- промотор (Рtrp) - промотор триптофатового оперона; tac-промотор (Ptac) - синтетический промотор с –10 областью от Plac, и –35 от Рtrp. Сильные промоторы обнаружены у фагов: промотор фага лямбда (Рl) и промотор фага Т7. Из них последний узнает только фаговая Т7РНК- полимераза. Поэтому вектор экспрессии, содержащий промотор фага Т7, должен содержать ген Т7РНК-полимеразы под регулируемым lac -промотором. В этом случае экспрессия белка под промотором Т7 начинается только после транскрипции гена Т7РНК-полимеразы. Для эффективной трансляции вектор экспрессии должен иметь последовательность Шайна-Дальгарно (SD) – это сайт связывания с рибосомой. Он состоит из 5-8 нуклеотидов, преимущественно пуринов (А и G), располагается вблизи (~ 10 п.о.) старт-кодона AUG, с которого начинается открытая рамка считывания (ORF). Последовательность SD должна быть комплиментарна сегменту на 3’-конце 16S рРНК, чтобы мРНК могла эффективно связаться с 30S субъединицей рибосомы. Сайт SD отсутствует в структуре генов эукариот. Поэтому чтобы эукариотический ген успешно экспрессировался в бактериях вектор экспрессии должен содержать последовательность SD вблизи 5’-конца клонированной ДНК. Такими свойствами обладают векторы серии рUC. Фьюжин-векторы (fusion) – это векторы-химеры на основе плазмид или фагов, содержащие регуляторную часть одного гена, а структурную часть другого гена. Клонируемый ген вводят в эти векторы так, чтобы регуляторная область бактериального гена оставалась неизменной, а встраивание происходило в его структурную часть. При совпадении рамки трансляции бактериального гена с рамкой трансляции встроенного гена синтезируется химерный белок, который обладает свойствами целевого экзогенного белка. Однако не всегда рамки трансляции бактериального и встраиваемого генов совпадают. В таких случаях клонируемая последовательность будет транслироваться неправильно. Чтобы преодолеть это затруднение, создают наборы векторов, в состав которых входит одна и та же регуляторная область, но в участке встройки чужеродных последовательностей в каждом векторе имеется сдвиг рамки трансляции относительно другого вектора. Обычно такой сдвиг достигается встройкой коротких синтетических фрагментов. Используя набор из трех векторов, можно клонируемую последовательность поместить во все три возможные фазы трансляции, относительно бактериального полипептида, с которым объединяется изучаемая ДНК. Одна из конструкций обязательно будет обеспечивать правильный синтез целевого белка. Челночные (бинарные) векторы – это гибридные плазмиды, которые способны реплицироваться как в клетках B. subtilis, так и в клетках E. coli. Чужеродные гены первоначально клонируют в методически более простой системе E. coli, для которой детально разработаны приемы генной инженерии. В этой же системе проводят целенаправленные модификации генно- инженерных конструкций, а затем отобранные и модифицированные двурепликонные гибридные плазмиды переносят в клетки B. subtilis. Используя двурепликонные векторы, можно изучать функционирование одной и той же генетической конструкции в клетках различных типов. Более того, векторы, содержащие участки инициации репликации различных организмов, например, E. coli дрожжей, и другие пары, способны реплицироваться в клетках бактерий и эукариот. Первые челночные плазмиды были получены в 1978 г. в лаборатории С. Эрлиха. Они состояли из двух плазмид, гидролизованных рестриктазой HindIII: pC194 (Cmr) и pBR313, pBR322 (AprTcr). Гибридные плазмиды реплицировались в клетках E. coli и B. subtilis. При этом в E. coli наблюдали экспрессию всех генов устойчивости к антибиотикам, а в B. subtilis – только гена cat (Cmr) плазмиды рС194. Векторы секреции. Одно из актуальных направлений генной инженерии бактерий – создание штаммов, секретирующих чужеродные белки. Перспективы их создания связаны с бациллами, поскольку эти бактерии эффективно секретируют различные белки в среду. Хорошо изучена секреция альфа-амилазы, пенициллиназы, протеазы, фосфатазы и рибонуклеазы. Эффективность секреции обусловлена присутствием в структуре этих белков сигнальных пептидов. Обычно у белков бацилл они длиннее (29-34 аминокислоты) по сравнению с белками грамотрицательных бактерий и животных (15-25 аминокислот). Клонируя гены секретируемых белков, и удаляя затем кодирующую последовательность зрелой формы, можно создать молекулярные векторы секреции для грамположительных бактерий рода Bacillus. Первый вектор секреции был создан в лаборатории И.Палва в 1982 г. на основе гена альфа-амилазы (amyE). Клонированный ген amyE модифицировали так, чтобы после сигнального пептида следовал участок узнавания рестриктазой. Был сконструирован вектор рКТН114, содержащий 5’- концевой сегмент гена amyE с лигированными HindIII-линкером и стоп- триплетами в трех рамках трансляции. Такой вектор был предназначен для клонирования кодирующих гетерологичных последовательностей. Применяя его, удалось осуществить синтез и секрецию из клеток B. subtilis различных эукариотических белков, включая интерфероны человека и мыши. В этой системе максимальный выход гетерологичных белков наблюдался в экспоненциальной фазе роста. Это обусловлено тем, что в фазе замедления роста у бацилл активируется синтез различных внеклеточных протеаз, расщепляющих чужеродный белок. Поэтому при создании штаммов- продуцентов бацилл большое внимание уделяют получению протеазо- дефицитных мутантов для использования их в качестве штаммов-реципиентов гибридных плазмид. Активность протеаз можно значительно снизить путем подбора питательной среды на основании данных о биосинтезе этих ферментов. Целенаправленное использование регуляторных элементов в структуре генов бацилл позволяет получить высокоуровневую продукцию. Так биосинтез нейтральной (npr) и щелочной (apr) протеаз у B. amyloliquefaciens в оптимальных условиях роста может достигать 3-5 г/л. Такой высокий уровень синтеза представлял интерес для создания на основе этого гена высокоэффективного вектора секреции. Был получен вектор рЕS150 (1986 г.), содержащий промоторную область, сигналы инициации трансляции (SD) и препропептидную область гена npr. В правильной рамке трансляции к фрагменту гена npr лигировали кодирующие последовательности генов гормона роста и фибробластного интерферона человека и получили эффективную секрецию чужеродных белков рекомбинантными клетками бацилл. При этом интерферон человека продуцировался на уровне 109 ед/л. Исследования по созданию векторов на основе секретируемых белков бацилл показали, что не всегда конструирование эффективно. Процесс экспорта зависит не только от присутствия сигнального пептида в структуре вектора, но также от других факторов, обеспечивающих транслокацию, транспорт через клеточную стенку и фолдинг секретируемого белка. Более того, встраиваемая ДНК должна содержать промотор, участок связывания рибосом, сигнальный пептид и чужеродный ген в правильной ориентации, при этом рамка трансляции последнего должна совпадать с сигнальным пептидом. Поэтому для достижения результата обычно создают набор гибридных клонов с использованием гидролизатов ДНК, полученных различными рестриктазами. Принципиально-новым этапом в развитии этих исследований является получение генно-инженерных штаммов на основе иммобилизованных клеток бацилл. Иммобилизованные клетки B. subtilis, несущие вектор секреции, содержащий промоторную область гена пенициллиназы B. licheniformis и кодирующую область гена проинсулина крысы, секретировали в среду целевой белок в течение нескольких суток. Интегративные векторы. Культивирование генно-инженерных штаммов бактерий в производстве протекает в течении длительного времени и может сопровождаться потерей плазмид. В других случаях нестабильность рекомбинантных плазмид может быть вызвана токсическим эффектом целевого продукта. При этом штаммы, утратившие плазмиду, получают селективное преимущество. Для преодоления этих трудностей проводят интеграцию чужеродной ДНК в хромосомную ДНК клетки-реципиента. Встраивание чужеродной ДНК в геном проводят с помощью интегративных векторов. Интегративный вектор содержит сегмент ДНК, гомологичный фрагменту бактериальной хромосомы. С помощью рекомбинации вектор способен с высокой эффективностью встраиваться в хромосомную ДНК. Такие векторы содержат гены резистентности к антибиотикам. Используя интегративные векторы можно встраивать в геном чужеродную ДНК. В процессе интеграции плазмид может происходить их тандемная дупликация. Для E. coli показано, что плазмида pBR322, содержащая участок хромосомной ДНК E. coli, интегрирует в геном бактерий в множестве копий при культивировании этих бактерий на среде с повышенной концентрацией антибиотика. После интеграции в геном B. subtilis плазмиды pC194 с геном cat (Cmr), можно добиться ее многократной дупликации на средах с повышающейся концентрацией хлорамфеникола. Явление амплификации, по-видимому, связано с процессом ответа организма на условия среды. Таким образом, в условиях, позволяющих поддерживать амплифицированное состояние интегративного вектора, можно добиться высокого выхода целевого продукта. И.Палва с сотрудниками (1987 г.) сравнивали продукцию внеклеточной альфа-амилазы, ген которой экспрессировался с плазмиды, или с двух копий гена в составе хромосомы. Оба штамма показали приблизительно одинаковый результат, в то же время штамм с интегрированными копиями гена amyE отличался более продолжительным временем синтеза фермента. Последняя характеристика свидетельствует в пользу промышленного применения штамма с интегрированным чужеродным геном. Итак, конструирование генно-инженерных штаммов требует индивидуального подхода и анализа всех факторов, от которых зависит выход целевого продукта. После создания векторной системы необходимо подобрать условия для эффективной репликации и структурной стабильности рекомбинантных плазмид. Особенно это важно для крупномасштабного культивирования. Нестабильность структуры может быть обусловлена влиянием сильного промотора, содержащегося в проклонированном фрагменте, рекомбинационными событиями, приводящими к делециям. При трансформации челночных плазмид они могут подвергаться атаке систем рестрикции, что также приводит к появлению делеционных производных. Делеционные плазмиды, как правило, при последующем пассировании стабильно сохраняют свою структуру. Векторные молекулы ДНК Для создания векторов для переноса чужеродной ДНК используют плазмиды, бактериофаги и вирусы. Вектор должен обладать следующими характеристиками: обеспечивать репликацию чужеродного фрагмента ДНК, иметь уникальные сайты рестрикции и содержать генетический маркер для отбора рекомбинантных клонов. Плазмиды – это внехромосомные автономно реплицирующиеся молекулы ДНК, не способные к самостоятельному существованию вне клетки. У одних плазмид репликация строго зависит от соответствующих ферментных систем бактерий, это плазмиды с узким спектром хозяев, часто они присутствуют только в клетках одного вида бактерий. Другие плазмиды кодируют белки, которые обеспечивают относительную автономность их репликации. Такие плазмиды способны реплицироваться в бактериях, относящихся к разным видам. Плазмиды несут гены, которые обуславливают фенотипическое отличие содержащих их клеток от бесплазмидных (селективный маркер), (Рис. 2).
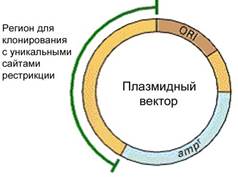
Рис. 2. Структура плазмидного вектора: ori –сайт инициации репликации, ampr - ген устойчивости к антибиотику, обеспечивающий селективный отбор, регион для клонирования должен содержать уникальные сайты рестрикции.
Плазмиды, не выявляемые фенотипически, называют криптическими. Различают плазмиды высокой и низкой копийности. Репликация первых находится под ослабленным контролем, в результате чего число их копий в клетках может составлять от 10 до 200. Репликация плазмид низкой копийности находится под строгим контролем и число их копий в клетке составляет от 1 до 10. В основе классификации плазмид – их деление по группам несовместимости (Inc-группы). К одной Inc-группе относят плазмиды, которые несовместимы между собой, но совместимы с любой плазмидой из других групп. Плазмиды, относящиеся к одной Inc-группе, обладают, как правило, многими сходными признаками и часто обнаруживают значительную гомологию ДНК. В основе методов выделения ДНК плазмид два принципиальных различия плазмидной и хромосомной ДНК: хромосомная ДНК существенно больше плазмидной ДНК и является линейной молекулой в отличие от ковалентно замкнутой молекулы плазмидной ДНК. Выделение хромосомной ДНК должно включать осаждение, при котором удаляются преимущественно длинные фрагменты хромосомной ДНК. В щелочной среде (рН 10) происходит денатурация обоих молекул ДНК. При нейтрализации среды (рН 7) небольшие кольцевые ДНК плазмид эффективно ренатурируют в отличие от линейных фрагментов хромосомной ДНК, которые из-за крупных размеров не способны к точной ренатурации. Итак, плазмиды обладают основными свойствами, позволяющими использовать их в качестве вектора для переноса чужеродной ДНК: небольшой размер, наличие уникальных сайтов рестрикции для молекулярного клонирования и селективного маркера для идентификации реципиентных клеток. С помощью плазмидных векторов можно клонировать фрагменты ДНК размером до 10 кб. С увеличением размера вставки вектор элиминирует при пассировании. Для работы с более крупными фрагментами ДНК в 1974 г. были разработаны векторы на основе фага лямбда E. coli. Векторы на основе фага l. ДНК фага лямбда - это линейная двухцепочечная молекула размером около 48502 п.о. с одноцепочечными 5’- концами из 12 нуклеотидов. Их называют cos -концами (cos -сайтами), они взаимокомплементарны и могут спариваться друг с другом с образованием кольцевой молекулы. В зрелых вирионах ДНК находится в форме линейной молекулы, попадая в клетку, ДНК циклизуется по соs -сайтам и функционирует в кольцевой форме. Стратегия клонирования. Третья часть ДНК фага лямбда, около 20 кб, расположенных в середине, несущественна для размножения фага и ответственна за встраивание в хромосомную ДНК (Рис. 3).
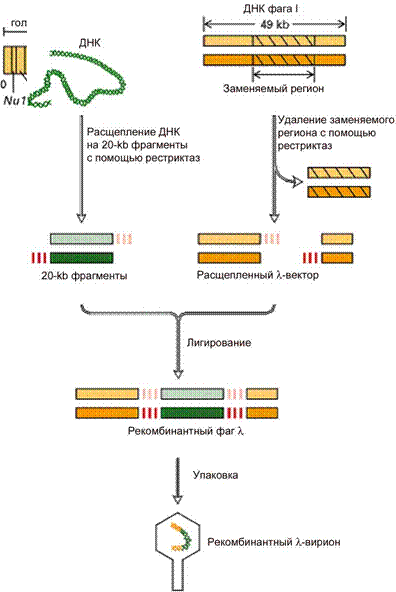
Рис. 3. Структура генома фага и конструирование векторов на основе бактериофага лямбда [http://www.ncbi.nih.gov/book/Molecular Cell Biology /recombinant DNA and Genomics]
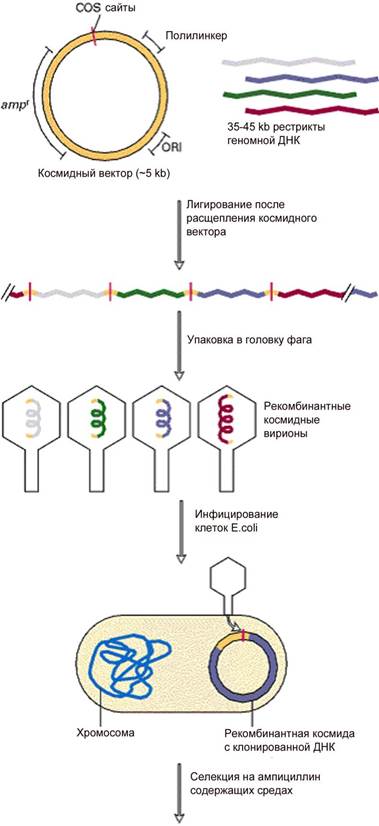
Этот сегмент можно заменить чужеродной ДНК. Рекомбинантная ДНК будет реплицироваться как фаговая ДНК по литическому пути развития. Фаговая ДНК упаковывается в головки в цитоплазме клеток E. coli. Упаковочная реакция лежит в основе клонирования: смешав в пробирке пустые головки, рекомбинантную ДНК и отростки можно получить зрелые фаговые частицы. ДНК фага лямбда имеет два BamHI-сайта, фланкирующих участок размером около 20 кб. При гидролизе фаговой ДНК рестриктазой BamHI образуются три фрагмента – L-левое плечо, которое содержит информацию о головке и отростке фага лямбда, R-правое плечо, которое содержит информацию о репликации фаговой ДНК и лизисе бактериальной клетки (Рис. 3). Средний сегмент ДНК кодирует белки, ответственные за интеграцию в хромосомную ДНК. Этот участок фаговой ДНК замещается чужеродной ДНК. ДНК, предназначенная для клонирования, предварительно расщепляется рестриктазой BamHI, рестрикты фракционируют и отбирают фрагменты размером до 20 кб (Рис. 3). Оба препарата, фаговую и чужеродную ДНК смешивают в одной пробирке и обрабатывают ДНК-лигазой. Лигированная смесь будет содержать разные комбинации ДНК, в том числе и восстановленную ДНК фага лямбда. Далее рекомбинантные молекулы смешивают с головками и отростками фага лямбда, и in vitro происходит самосборка зрелых фаговых вирионов. Правило таково, что в фаговые головки упаковываются только фрагменты около 50 кб, ДНК по размеру более 52 кб не умещается в головку, ДНК по размеру менее 38 кб после упаковки дает не инфицирующие фаговые частицы. На следующем этапе необходимо отделить рекомбинантные фаги. Для этого ими инфицируют клетки E. coli, в хромосому которых интегрирован фаг Р2. Клетки E. coli -Р2 приобретают иммунитет на другие бактериофаги, способные встраиваться в хромосому. Поэтому инфицировать такие клетки способны только рекомбинантные бактериофаги с делетированной областью интеграции. Полноценные фаги лямбда не включаются в клетки E. coli -Р2. Преимущество использования фага лямбда перед плазмидами в том, что можно клонировать до 20 кб чужеродной ДНК. Эффективность внедрения рекомбинантных фагов составляет 100% в отличие от трансформации, при которой эффективность внедрения ДНК составляет 10-4-10-5. Некоторые продукты чужеродных генов токсичны, их трудно клонировать на плазмиде. В этом случае идеально подходит вектор на основе фага лямбда не интегрирующего типа. Хозяйские клетки быстро лизируют и токсичность для их жизнедеятельности не актуальна. И в заключении, векторы на основе фага лямбда являются эффективными векторами экспрессии для получения белковых продуктов. Они имеют сильные промоторы (РL и РR) и антитерминальный белок N, подавляющий терминацию транскрипции. Космиды – это плазмиды с cos -сайтами фага лямбда. Космиды могут амплифицироваться как плазмидный вектор в клетках E. coli и быть нагруженными до 40 кб чужеродной ДНК. С другой стороны, с помощью cos - сайтов космиды могут быть упакованы в лямбда вирион. Космида содержит cos -сайты фага лямбда, полилинкер с шестью уникальными сайтами рестрикции, ori E – точку начала репликации E. coli и в качестве детерминирующего признака - ген устойчивости к антибиотику (amp r) (Рис. 4). ДНК, предназначенную для клонирования, гидролизуют рестриктазой BamHI и фракционируют фрагменты по 40 кб. Космидный вектор сначала обрабатывают рестриктазой с образованием линейной молекулы ДНК. Препараты чужеродной и векторной ДНК смешивают и лигируют. Продукты лигирования, которые содержат 40 кб вставку чужеродной ДНК, имеют суммарную ДНК размером 50 кб и, таким образом, способны упаковываться in vitro в головки фага лямбда. Фаговый фермент узнает cos -последовательности ДНК и катализирует упаковочную реакцию. После сборки фаговых частиц ими инфицируют клетки E. coli. В бактериальной клетке линейная молекула вектора, содержащая чужеродную ДНК, циклизуется благодаря cos -сайтам. Она может долго существовать в такой стабильной конфигурации и реплицироваться как гибридная плазмида. Ген устойчивости к антибиотику обеспечивает рост бактерий на селективной среде. Нетрансформированные клетки при этом погибают.
Рис. 4. Клонирование на космидном векторе [http://www.ncbi.nih.gov/book/ Molecular Cell Biology /recombinant DNA and Genomics] Преимущества космидных векторов. В космидный вектор можно встраивать более протяженные фрагменты ДНК (40 кб) по сравнению с плазмидным или фаговым вектором, поскольку собственная ДНК космидного вектора мала, около 10 кб и способна эффективно доставлять рекомбинантную ДНК с помощью фага лямбда. По этой причине космиды используют при клонировании геномной ДНК эукариот. Фазмиды – это искусственные гибридные векторы, включающие ДНК фага и плазмиды. Фазмиды после встройки чужеродной ДНК могут в одних условиях развиваться как фаги, а в других как плазмиды. Исходно фазмида имеет размер до 30 кб. В ее состав входит до 70% генома фага, включая cos - cайты и ori -последовательность фага. В то же время фазмидный вектор содержит ori -последовательность плазмиды. Хотя фазмида содержит все гены, необходимые для литического развития фага лямбда, она не способна к образованию негативных колоний, поскольку столь малая ДНК не упаковывается в капсиды. Фазмида поддерживается в клетках E. coli в виде плазмидного вектора. При встраивании чужеродной ДНК in vitro происходит увеличение размера вектора, что придает фазмиде свойства недефектного фага. Таким образом, размер вставки составляет до 20 кб, что соотносится с размером вставки для векторов на основе ДНК фага лямбда. Фазмидную ДНК выделяют из клеток бактерий как плазмидную ДНК, гидролизуют рестриктазой, лигируют с продуктами гидролиза чужеродной ДНК, предназначенной для клонирования, а затем проводят упаковку рекомбинантной ДНК в капсиды фага лямбда. Преимущества фазмид. Применение фазмидных векторов значительно упрощает процедуру получения и отбора рекомбинантных векторов, поскольку только рекомбинантные фазмиды образуют на бактериальном газоне фаговые бляшки. В отличие от космидной или фаговой векторных систем, фазмидный вектор существует в клетке в виде плазмиды, а клонотека хранится в виде суспензии гибридных фагов. Векторы на основе однонитевых фагов. В плазмидах или производных фага лямбда чужеродная ДНК находится в двухцепочечной форме. Тем не менее, имеются экспериментальные задачи, которые базируются на манипуляциях с одноцепочечной ДНК. Например, определение последовательности нуклеотидов (секвенирование), выделение комплементарной РНК или олигонуклеотид-направленный мутагенез. В этих случаях приходится денатурировать молекулы ДНК, но это не всегда просто. Поэтому возникла потребность клонировать ДНК в одноцепочечных векторах. Для этой цели используют нитевидные фаги E. coli: M13, fd и f1. Длинные (около 900 нм), тонкие (7 нм) и гибкие вирионы этих фагов представляют собой кольцевую одноцепочечную ДНК (оцДНК) длиной 6407 нуклеотидов (М13) и 6408 нуклеотидов (fd и f1). Фаговая ДНК упакована в трубочку из 2700 копий основного оболочечного белка рVIII и закрытую на концах четырьмя или пятью молекулами каждого из четырех минорных оболочечных белков. Нитевидные фаги адсорбируются на F-пилях E. сoli и поэтому способны инфицировать только F+-клетки бактерий. Особенности генома ДНК фага М13. ДНК фага М13 не имеет участков узнавания для рестриктаз, образующих липкие концы. Фаговый геном не содержит генетических маркеров, которые позволили бы выявить гибридные фаги. Поэтому создание векторов клонирования на основе М13 включает введение в геном фага селективных маркеров и уникальных сайтов рестрикции, т.е. полилинкеров. В геноме нитевидных фагов нет области, несущественной для жизнедеятельности фагов. Для конструирования используют межгенную область протяженностью 500 нуклеотидов (IR-область). Все модификации этого участка ДНК (делеции, вставки) проходят без нарушения жизнеспособности фага. Рекомбинантные фаговые векторы получают путем клонирования чужеродной ДНК в этом участке фагового генома. По величине вставка не имеет ограничений, хотя вставки очень большого размера имеют тенденцию к спонтанному элиминированию. Однонитевые фаги заражают клетки E. coli. и непрерывно в них размножаются. Образующиеся фаговые частицы постоянно экскретируются клетками без лизиса последних, процесс является энергозависимым. В течении одной генерации образуется несколько сотен фагов на клетку (200-300 копий на клетку). Векторная система на основе нитевидных фагов интенсивно развивается, и получила название фаговый дисплей. Фагмиды. Расширить возможности использования одноцепочечных векторов удалось путем совмещения плазмид и нитевидных фагов в одну молекулу ДНК. Такие векторы были названы фагмидами. Для получения фагмидного вектора плазмидную ДНК лигируют с репликативной формой ДНК фага, которая содержит все действующие элементы фагового генома, необходимые для его репликации, а также IR-область, необходимую для молекулярного клонирования. Созданный гибридный вектор обладает свойствами плазмид и фагов. Внутри клеток-хозяев фагмиды размножаются как плазмиды потому, что у них, как правило, отсутствуют гены, необходимые для сборки фаговой частицы. Они размножаются как фаги, если хозяин инфицирован вспомогательными фагами, которые поставляют белки для упаковки. Какая из цепи фагмиды (кодирующая (+) или матричная (-)) будет упакована в фаговый капсид зависит от ориентации ДНК фага в плазмиде. Векторные системы на основе нитевидных фагов успешно применяются для разработки новой технологии фагового дисплея белков, пептидов и антител. Ее суть заключается в том, что в составе фаговых капсидов экспрессируются целевые последовательности полипептидов, которые после сборки экспозируются на их поверхности. Вирионы с гибридными молекулами на поверхности легко тестировать, интересующий исследователя вариант выделить и размножить для дальнейшего изучения. Данное направление исследований имеет большое будущее. Искусственные бактериальные хромосомы. В 1992 г. японские исследователи Х. Шизуя с соавторами описали новую бактериальную векторную систему, позволяющую клонировать фрагменты чужеродной ДНК размером до 300 кб. Эта система названа бактериальная искусственная хромосома - ВАС (bacterial artificial chromosome). Основа вектора – F-плазмида (Рис. 5).
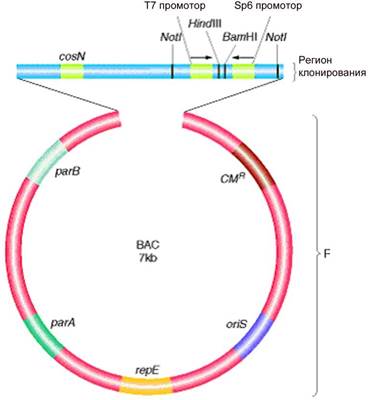
Рис. 5. Структура искусственной бактериальной хромосомы ВАС [http://www.ncbi.nih.gov/book/ Modern Genetic Analysis/recombinant DNA technology]
Репликация и копийность F-плазмиды находятся под строгим контролем, копийность составляет 1-2 молекулы на клетку. Это является важной характеристикой, поскольку высококопийные векторы находятся под ослабленным контролем и им свойственна структурная нестабильность, могут происходить нежелательные делеции или перестройки клонированных фрагментов ДНК. Вектор ВАС создан на основе F-плазмиды и содержит ее регуляторные генетические локусы: oriS – инициация репликации, продукт repE гена обуславливает однонаправленную репликацию фактора F c oriS – сайта, а продукты генов parA и parB обеспечивают правильное распределение фактора F между делящимися клетками и поддерживают копийность на уровне 1-2 молекул. В F-плазмиду по сайту SalI был встроен фрагмент ДНК, который содержал cos -сайты фага лямбда. Кроме того, встроенный фрагмент содержал уникальные сайты рестрткции BamHI и HindIII, предназначенные для клонирования, к ним подстыкованы сильные промоторы фагов Т7 и Sp6 для эффективного синтеза целевой ДНК, а также сайты NotI для крупнощепящей рестриктазы для выщепления клонированных фрагментов. Такой вектор японские исследователи лигировали с HindIII-рестриктами хромосомной ДНК человека. Полученные рекомбинантные плазмиды они вводили электропорацией в клетки E. coli и отбирали рекомбинантные клоны по устойчивости к антибиотику (Cmr). После гидролиза клонов рестриктазой NotI был определен размер вставки, он составил 125-300 кб. Пассирование клонов продемонстрировало их высокую стабильность. Аналогами ВАС- векторов являются РАС-векторы, которые созданы на основе фага Р1. ВАС и РАС векторы используются при анализе сложных геномов и сыграли определяющую роль в картировании и секвенировании генома человека. Он
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 432; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.200.93 (0.014 с.) |