
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль озону в збереженні життя на ЗемліСодержание книги
Поиск на нашем сайте Біля поверхні Землі озону мало. З віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20-25 км. Там утворюється так званий озоновий шар. Озоновий шар відіграє значну роль у збереженні життя на нашій планеті, він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові захворювання шкіри). Крім того озоновий шар разом з вуглекислим газом Озон утворюється у верхніх шарах атмосфери внаслідок поглинання киснем ультрафіолетового випромінювання Сонця:
Озон, що утворився, огортає Землю з усіх боків, але молекули озону існують недовго, відбувається зворотна реакція фотохімічного розкладу озону: Отже, в атмосфері існує цикл озону – його збалансоване утворення і розклад. Результатом існування цього циклу є перетворення ультрафіолетового випромінювання Сонця на теплову енергію. Але для нас головна „заслуга” озону полягає в тому, що він, жертвуючи собою, поглинає ультрафіолетове випромінювання і тим самим не допускає високоенергетичні фотони сонця до Землі. Під впливом забруднення навколишнього середовища озоновий шар руйнується, внаслідок чого утворюються „озонові діри”, які збільшують ультрафіолетове навантаження на все живе на Землі. Над територією України (окрім південної частини) загальний рівень озону зменшився на 6%. Особливо небезпечна озонова дірка влітку. У цей період дуже потерпають очі, тому треба користуватися сонцезахисними окулярами. Варто утриматись і від засмаги, щоб не зашкодити шкірі. Сірчистий газ Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфікуючий засіб (для знищення плісняви в підвалах, льохах, винних бочках, бродильних чанах). Сульфур (IV) оксид, потрапляючи в повітря, викликає утворення кислотних дощів, шкідливих для всього живого на планеті. Селен Селен – елемент молодості, бореться зі старінням та блокує розвиток раку. Селен – елемент, який не дає вам старіти. Уявіть собі дивовижну речовину, яка не дає вам старіти. Уявіть собі дивовижну речовину, яка не дає підступним вірусам, у тому числі вірусу СНІДу, вирватися з клітини й почати сіяти смерть і руйнування. Це Селен, могутній антиоксидант і важливий мікроелемент з різними омолоджувальними властивостями. Коли у ваших клітинах зменшується вміст Селену, а так завжди відбувається з віком, ваша імунна система порушується і ви стаєте більш підвладні раку та іншим інфекційним захворюванням. З віком рівень Селену в нашому організмі знижується: після 60 років – на 7%, а після 75 – на 24%. Зменшення кількості Селену в організмі свідчить про те, що у вашій крові та тканинах діє менше антиоксидантів. Люди з низьким рівнем Селену в організмі часто хворіють на рак і артрит, а також підвладні серцевим захворюванням. У тварин Селен гальмує розвиток майже 100% різних пухлин. А люди, в яких низький рівень Селену та які харчуються продуктами з низьким умістом цього елемента, більш схильні до раку молочної залози, шкіри, трахеї і легень. Селен є одним із таких антиоксидантних препаратів, які різко знизили смертність від раку, і відіграє велику роль для профілактики раку легень. Селен бореться з онкологічними захворюваннями, запобігаючи мутації, відновлюючи завдані клітинам ушкодження й активізуючи імунну систему. Він бореться із захворюваннями серця. Як показали дослідження у Фінляндії, люди з найбільш низьким рівнем Селену в крові втричі більше підвладні смерті від серцевих захворювань, ніж ті, в яких Селену виявилось більше. Чим нижчий рівень Селену в крові, тим вищий ступінь закупорки артерій. Селен сприятливо впливає на серце кількома шляхами: він зберігає артерії, запобігаючи утворенням накопичень бляшок, які викликають інсульти та інфаркти. Селен уповільнює окиснення холестерину, який вважають основним винуватцем закупорки артерій. Уживання Селену може відновити молодість і здоров’я імунної системи людині; Селен може допомогти організму контролювати віруси. Нині вважають, що вірус СНІДу повільно позбавляє організм Селену, а коли запаси елемента виснажуються, вірус виривається з інфікованої клітини в пошуках нових запасів, таким чином поширюючи інфекцію, нападаючи на здорові клітини. Отже, Селен може впливати на лікування всіх типів вірусних захворювань. У людей, які вживають Селен з вітаміном Е, спостерігається значне поліпшення настрою і розумової діяльності, а також посилений приплив крові до мозку. Отже, можна поповнити організм Селеном із зерна насіння соняшника, м’яса, морських продуктів – особливо тунця, риби-меч, устриць. А щоб захиститися від раку, потрібно вживати препарати Селену від 100-200 мкг на день. Але у великих дозах Селен може бути токсичним. Отже, щоб бути завжди здоровими, потрібно споживати продукти, багаті на Селен. Фосфор в організмі людини У тілі людини масою 70 кг міститься близько 780 г Фосфору. У вигляді кальцій фосфатів Фосфор присутній у кістках людини. Він також міститься в кістках тварин. Входить до складу білків, фосфоліпідів, нуклеїнових кислот. Щоденна потреба людського організму у Фосфорі становить у 1,2 г. Основна його кількість споживається з молоком і хлібом. Найбільше багаті на Фосфор риба, квасоля, деякі види сиру. Для правильного харчування необхідно дотримуватись балансу між кількістю споживаного Фосфору і Кальцію. Оптимальне співвідношення складає 1,5:1. надлишок багатої на Фосфор їжі призводить до вимивання Кальцію з кісток, а за його надлишку розвивається сечокам’яна хвороба. Нітроген Нітроген входить до складу багатьох органічних сполук: білків, нуклеїнових кислот, алкалоїдів, антибіотиків. Без білків немає життя, а без Нітрогену немає білків, тому зрозумілою стає його роль у живій природі. Зв’язаний Нітроген може в незначних кількостях потрапити в грунт завдяки грозовим дощам і бобовим рослинам. Нітроген – це елемент без якого неможливе існування рослин на Землі, але його кількість має бути в межах тієї норми, яка потрібна рослині. Якщо рослина містить недостатню кількість Нітрогену, то затримується її ріст і розвиток, гальмується ріст і формування листків: вони стають дрібними, мають ясно-зелений колір і передчасно жовтіють унаслідок зменшення вмісту хлорофілу. Крім того, якщо не вистачає Нітрогену, стебла стають тонкими і слабко розгалужуються, погіршується ріст і формування репродуктивних органів. Надлишок Нітрогену призводить до надмірного розвитку вегетативної маси, знижує стійкість рослин до несприятливих умов, грибних і бактеріальних хвороб. Хімічні елементи, як і вся природа, перебувають у постійному русі. Процеси відбуваються в усіх трьох оболонках Землі – літосфері, гідросфері, атмосфері. Значну роль у процесах, що відбуваються у природі, відіграє біосфера – зона існування живих організмів. Відомо, що Нітроген входить до складу білків, а отже, зумовлює існування рослин, тварин узагалі життя на Землі. Рослини засвоюють Нітроген з неорганічних сполук, які є в ґрунті. Нітроген входить до складу мінеральних азотних добрив: мінеральні добрива –селітри Нітрати лужних металів, крім того, використовують як компоненти ракетного палива та піротехнічних сумішей, для виробництва вибухових речовин, скла, ліків і для обробки та консервування харчових продуктів. Так, натрій нітрат Зменшити кількість нітратів можна, якщо всі овочі та фрукти ретельно помити перед уживанням гарячою водою, після чого яблука, огірки почистити, а з моркви вирізати серцевину. Зниженню шкідливого впливу нітратів сприяє вживання вітамінів, особливо А, Е, Карбон Карбон – типовий елемент IV групи, головної підгрупи періодичної системи хімічних елементів. Електронна формула Карбону - У природі зустрічається три алотропні форми Карбону: алмаз, графіт і карбін. Алмаз – найтвердіший з усіх відомих речовин, тому використовується для свердління твердих порід, виготовлення різців, свердел, різання скла. Чисті алмази – безбарвні, прозорі. Їх гранують, шліфують і виготовляють із них діаманти. Прозорі алмази красивого синього, зеленого, червонуватого кольору надто рідкісні й оцінюють дуже високо. Чим більше граней має кристал, тим краще він „виграє”. Маса діамантів вимірюється каратами (1 карат=0,2 г). Нині розроблено штучне одержання алмазів з графіту в умовах високих тисків і температур. Ці алмази використовують для виготовлення різальних інструментів і як опору для підшипників та інших рухливих частин у точних вимірювальних інструментах. Нині виробляються й синтетичні алмази ювелірної якості. Промисловий синтез алмазів – велике досягнення науки і техніки. Графіт – кристалічна речовина, жирна на дотик, сірого або чорного кольору з металічним блиском. Структура графіту шарувата – атоми Карбону розміщені шарами, що складаються з шестичленних кілець. Графіт тугоплавкий, температура плавлення 3800 С, хімічно дуже стійкий. З нього виготовляють вогнетривкі тиглі, синтетичні алмази, електроди, обкладки для електролітичних ванн, труби теплообмінників. В ядерних реакторах графіт використовують як уповільнювач нейтронів. З графіту роблять грифелі для олівців. У промисловості крім природного використовують штучний графіт. Його виготовляють з кращих сортів кам’яного вугілля (кокс, антрацит) в електропечах за температури 2600-3000 С і тиску 250 М Па без доступу повітря. Активоване вугілля чудовий адсорбент. Саме тому його використовують у промисловості для очищення газів, вловлювання цінних органічних розчинників, виготовлення протигазів, у медицині для очищення крові й видалення шкідливих речовин зі шлунково-кишкового тракту. Силіцій Силіцій – компонент електротехнічних сталих сплавів з алюмінієм. Він є другим елементом після Оксигену за поширенням у природі, його масова частка в земній корі 26,6%. Але у вільному стані він не зустрічається, тільки у вигляді сполук. Найпоширенішою сполукою Силіцію є силіцій оксид Силіцій у вигляді силікатів і алюмосилікатів входить до складу таких мінералів як азбест, тальк, польовий шпат, нефелін, слюда. Він входить і до складу рослинних (хвощі, бамбук) і тваринних організмів (кістяк, сполучна тканина). ЧАДНИЙ ГАЗ - СО СО – чадний газ, безбарвний газ, без смаку, легший за повітря, погано розчиняється у воді, але надзвичайно отруйний. Він уражає кров, м’язову тканину, нервову систему, серце людини. У тютюновому димі його міститься 0,5-1%, а у вихлопних газах автомобіля – до 10% СО. Цей газ реагує з гемоглобіном у 200-300 разів швидше, ніж кисень, утворюючи карб оксигемоглобін. Тому гемоглобін утрачає здатність переносити кисень, що призводить до кисневого голодування тканин. Якщо в повітрі міститься 0,2% СО, людина непритомніє, за 1% вона помирає. Ось чому спецслужби стежать за вмістом в атмосфері СО, а ми повинні провітрювати приміщення, особливо із пічним опаленням, щоб не вчадіти. А скільки зусиль докладає природа, що, самоочищаючись, використовує СО? Він окислюється до карбон діоксиду, який поглинають рослини й мікроорганізми, адсорбується ґрунт
|
||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 325; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.01 с.) |

 поглинає інфрачервоне випромінювання Землі й тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі.
поглинає інфрачервоне випромінювання Землі й тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі.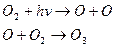



 ,
,  ,
,  , органічні добрива – гній, компост, послід та зелені добрива (люпин, горох, конюшина).
, органічні добрива – гній, компост, послід та зелені добрива (люпин, горох, конюшина). , який перешкоджає окисленню м’яса і зберігає рожевий колір м’ясних виробів, поліпшує смак сирів, облагороджує їх запах. У домашніх умовах використання нітратів і нітритів неприпустиме, бо вживання навіть дещо перевищеної норми цих солей може призвести до порушення функції крові як переносника кисню й створити загрозу для життя. Адже нітрати спричинюють набряк легенів, кашель, блювоту і серцеву недостатність. Нітрити, зокрема
, який перешкоджає окисленню м’яса і зберігає рожевий колір м’ясних виробів, поліпшує смак сирів, облагороджує їх запах. У домашніх умовах використання нітратів і нітритів неприпустиме, бо вживання навіть дещо перевищеної норми цих солей може призвести до порушення функції крові як переносника кисню й створити загрозу для життя. Адже нітрати спричинюють набряк легенів, кашель, блювоту і серцеву недостатність. Нітрити, зокрема  .
. показує, що в його атомах на зовнішньому електронному шарі міститься по чотири електрони. В атомах Карбону і Силіцію на зовнішньому електронному шарі є вільна
показує, що в його атомах на зовнішньому електронному шарі міститься по чотири електрони. В атомах Карбону і Силіцію на зовнішньому електронному шарі є вільна  -орбіталь, тому один
-орбіталь, тому один  -електрон зовнішнього шару під час збудження атома переходить на цю
-електрон зовнішнього шару під час збудження атома переходить на цю  . Це мінерал кварц і багато його різновидів – пісок, кремінь, яшма, опал, агат, аметист.
. Це мінерал кварц і багато його різновидів – пісок, кремінь, яшма, опал, агат, аметист.



