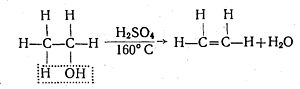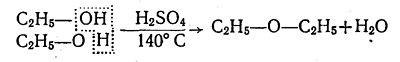Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інструкція для виконання лабораторної роботи № 5Содержание книги Поиск на нашем сайте
Тема: Властивості спиртів. 1 Мета: 1.1Єксперементально ознайомитися із властивостями спиртів. 1.2 Закріпити теоретичні знання на практиці. 2 Матеріально-технічне та навчально-методичне забезпечення: 2.1Етиловий спирт. 2.2Пробірки. 2.3Спіраль із мідної дротини. 2.4Гліцерин, сульфат міді, р-н натрій гідроксид(10%), сульфатна кислота(концентрована). 2.5Пісчана баня 3 Теоретичні відомості: Спирти — похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені гідроксильними групами (-OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом Карбону називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома — триолами і т. д. В українській мові їх також називають багатоатомними спиртами. Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним, коли дві — двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні. Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю -CH2-. Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол. Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал. В таблиці наведений гомологічний ряд насичених одноатомних спиртів. Нижчі спирти (з малою кількістю атомів Карбону в молекулі) при звичайній температурі є леткими рідинами, а вищі, починаючи з C15H31—OH, — тверді речовини. Нижчі спирти з водою зміщуються у всіх співвідношеннях. З підвищенням молекулярної маси розчинність спиртів зменшується. Усі спирти легші від води. В міру збільшення молекулярної маси температура кипіння спиртів підвищується. Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами. Наприклад: 2C2H5—OH + 2Na → 2C2H5—ONa + H2 ↑ У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється бромоетан:
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
При слабшому нагріванні (близько 140 °С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома Гідрогену спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100 °C) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
При повному окисненні спиртів утворюються вуглекислий газ та вода. C2H5OH + O2 → CO2 + H2O Гліцери́н (гліцеро́л) — трьохатомний спирт. Хімічна формула — C3H8O3, або C3H5(OH)3.Молекулярна маса 92,09 г/моль. Температура кипіння 290 °C (розкладається). Температура плавлення 20 °C. Змішується з водою в будь-якій пропорції. Густина 1,261 г/см3 при 20 °C. Показник заломлення nD=1,4735 при 20 °C. Діелектрична проникність ε=42,5 при 25 °C. Дипольний момент молекули в газовому стані μ=2,56 Дб. В'язкість 9450 мПз[3]. Це безбарвна, в`язка, сиропоподібна, без запаху, солодка на смак, важча за воду і неотруйна рідина, що має здатність поглинати вологу з повітря та утримувати її. Наявність гідроксильних груп зумовлює подібність гліцерину до одноатомних спиртів, він вступає в ті самі реакції, але за участю трьох гідроксильних груп. Реакції повного окиснення (горіння) відбувається, як і в інших органічних речовин, з утворенням вуглекислого газу і води. Гліцерин вступає в реакцію заміщення з металічним натрієм, яка супроводжується виділенням водню. 2С3Н5(ОН)3+6Na à 2C3H5(ONa)3+3H2 Горіння: 2С3Н5(ОН)3+7О2 à 6CO2+8H2O З нерозчинними основами: C3H5(OH)3+Cu(OH)2 à C3H5(OH)3Cu +H2O. 4 Хід роботи: 4.1 Розчинність гліцерину у воді. Змішайте у пробірці воду і гліцерин (приблизно по 1 мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиниться він? Зробіть висновок про розчинність гліцерину у воді. 4.2 Взаємодія гліцерину з гідроксидом міді (ІІ). У пробірку налийте 1 мл розчину гідроксиду натрію чи калію і додайте кілька крапель розчину сульфату купруму (ІІ). Що спостерігаєте? Додайте гліцерин, суміш збовтайте. Що спостерігаєте? 4.3 Прокалити мідну спіраль аж до появи чорної окалини та опустити в пробірку з етиловим спиртом. Що спостерігаємо? 4.4 В пробірку налити 1 мл етилового спирту і 1 мл концентрованої сульфатної кислоти. Пробірку закріпити в пробірко тримачі і обережно опустити в нагріту баню, додаючи по краплинам етиловий спирт з іншої пробірки. Дослід потрібно проводити дуже обережно, так як ефір з повітрям утворює вибухову суміш. 5 Висновки: 6 Контрольні питання: 6.1 Де використовують спирти? 6.2 Які сполуки називають гліцератами? 6.3 У яких напрямках може відбуватися реакція заміщення у спиртів? Наведіть приклади. 6.4 Трускавецька мінеральна вода «Юзя» містить гліцерин. Здавна місцеві дівчата вмиваються нею «для краси». На яких властивостях, на вашу думку, заснована дія цієї води? Література 1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989. 2 Буринська Н.М., Величко Л.П. Хімія. Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 574; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.006 с.) |