Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інструкція для виконання лабораторної роботи № 7Содержание книги Поиск на нашем сайте
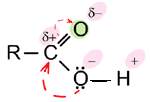
Тема: Вивчення властивостей карбонових кислот. 1 Мета: 1.1Єксперементально ознайомитися із властивостями карбонових кислот. 1.2 Закріпити теоретичні знання на практиці. 2 Матеріально-технічне та навчально-методичне забезпечення: 2.1 Пробірки, газовідвідна трубка. 2.2 Реактиви: натрій ацетату СН3СООNa, концентрованої сульфатної кислоти H2SO4, магнієві ошурки, купрум оксид CuО, натрій гідроксиду NaOH, етилового спирт. 3 Теоретичні відомості: Карбоновими кислотами називаються органічні сполуки, в молекулах яких містяться одна або декілька карбоксильних. Карбоксильна група складається з карбонільної і гідроксильної груп. В карбоксильній групі карбонільна і гідроксильна групи взаємно впливають одна на одну, тому властивості цих груп в кислотах не відповідають властивостям спиртів і альдегідів. Послаблення зв'язку між киснем і воднем у гідроксильній групі пояснюється відмінністю електронегативностей атомів вуглецю, кисню і водню. Атом вуглецю карбонільної групи набуває деякого позитивного заряду (електронна густина зміщується від нього вбік атома кисню карбонільної групи). В результаті цього атом вуглецю притягує до себе електронну хмару від атома кисню гідроксильної групи. Компенсуючи зміщену електронну густину, атом кисню гідроксильної групи відтягує на себе електронну хмару сусіднього атома водню. Внаслідок цього зв'язок між атомами кисню і водню в гідроксильній групі стає більш полярним, а атом водню — дуже рухливим, тобто відбувається зміщення електронів у карбоксильній групі:
Хімічні властивості карбонових кислот Розчини карбонових кислот у воді мають кислий смак, забарвлюють лакмус і метил оранжевий у червоний колір, проводять електричний струм, взаємодіють з металами з виділенням водню. Це свідчить, що органічні кислоти вступають у реакції, характерні для кислот. Розглянемо хімічні властивості карбонових кислот на прикладі оцтової кислоти.
Хімічні властивості карбонових кислот в порівнянні з неорганічними кислотами
У карбонових кислот під впливом карбоксильної групи збільшується рухливість атомів водню, які стоять біля атома вуглецю, сусіднього з карбоксильною групою. Тому вони легко заміщуються атомами хлору:
СН3СООН + СІ2 ® СН2СООН + HСІ ï СІ хлороцтова кислота 4 Хід роботи: 4.1Одержання оцтової кислоти. Помістити у пробірку 0,5г натрій ацетату СН3СООNa і додати 1мл концентрованої сульфатної кислоти H2SO4. Пробірку з сумішшю закрити пробкою з газовідвідною трубкою, кінець якої опустити у іншу суху пробірку. Суміш нагріти. У пробірку, куди виділяються пари оцтової кислоти, помістити універсальний лакмусовий папірець. Зробіть висновки. Напишіть рівняння реакції. 4.2 Взаємодія з металами. В пробірку помістити невелику кількість магнієвих ошурок, додати 1 мл оцтової кислоти. Закрити пробірку пробкою з газовідвідною трубкою, до отвору якої піднести палаючий сірник. Зробіть висновки. Напишіть рівняння реакції. 4.3 Реакція солеутворення з оксидами металів. В пробірку помістити невелику кількість купрум оксиду CuО (в кристалах). Додати 2 мл оцтової кислоти. Реакційну суміш підігріти. Що спостерігаєте? Напишіть рівняння реакції. 4.4 Реакція нейтралізації. В пробірку налити 1-2 мл натрій гідроксиду NaOH, додати по краплям (1-2) фенолфталеїну, а потім - розчин оцтової кислоти. Зробіть висновки. Напишіть рівняння реакції. 4.5 Реакція етерифікації. В пробірку налити 1-2 мл оцтової кислоти, додати рівну кількість етилового спирту та декілька крапель водовідбірної речовини (концентрованої Н2SO4). Вміст пробірки обережно нагріти. Утворену суміш вилити в стакан з насиченим розчином повареної солі. Зробіть висновки. Напишіть рівняння реакції.
5 Висновки: 6 Контрольні питання: 6.1 Як поводять себе карбонові кислоти у воді? 6.2 Яким індикатором не можна довести наявність катіону Гідрогену в розчині кислоти? Чому?
6.3 Поясніть, де при приготуванні їжі використовується реакція між оцтовою кислотою та питною содою? З якою метою? 6.4 Вапняний наліт на кранах, накип у чайнику - це кальцій карбонат. Як можна позбавитись накипу або вапняного нальоту, використовуючи влас-тивості оцтової кислоти?
Література: 1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989. 2 Буринська Н.М., Величко Л.П. Хімія. Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 434; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.108.80 (0.01 с.) |