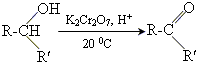Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інструкція для виконання лабораторної роботи № 6
Тема: Одержання і властивості альдегідів і кетонів. 1Мета: 1.1Єксперементально ознайомитися із властивостями альдегідів та кетонів. 1.2 Закріпити теоретичні знання на практиці. 2 Матеріально-технічне та навчально-методичне забезпечення: 2.1Пробірки 2.2 Водяна баня 2.3 Реактиви: 1% р-н нітрату срібла, 5% р-н аміаку, 10% р-н натрій гідроксиду, оцтовий альдегід, 2% р-н сульфату міді. 3 Теоретичні відомості: Загальним способом добування альдегідів є окиснення спиртів. Ми вже розглядали таку реакцію. Для ілюстрації цього способу проведемо такий дослід. Розжаримо в полум'ї спиртівки спіраль з мідної дротини й опустимо її в пробірку із спиртом. Помічаємо, що спіраль, яка вкривається при нагріванні темним нальотом оксиду міді (II), у спирті знову стає блискучою; одночасно відчуємо запах альдегіду:
На практиці як окисник використовують кисень повітря і проводять реакцію за наявності металічного каталізатора — міді. Так, формальдегід добувають, пропускаючи через реактор із розжареною міддю суміш пари метилового спирту з повітрям. Мідь при цьому не витрачається, вона є переносником кисню повітря. Освоєно також спосіб прямого окиснення етилену в оцтовий альдегід за наявності хлоридів паладію і міді:
Цей спосіб вважається найперспективнішим, бо в ваш, час етилен — доступніша і дешевша сировина для органічного синтезу, ніж ацетилен. Хімічні властивості альдегідів: 1приєднання водню
2 реакції окислення окислення біхроматом калію
3 реакція срібного дзеркала
4 реакція окислення гідроксидом Купруму(ІІ)
Кетонами називаються сполуки, в молекулах яких міститься група атомів >С = О, пов'язана з двома вуглеводневими радикалами. Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв'язків карбонільною групою витрачається на з'єднання з воднем, а в молекулах кетону обидва зв'язки йдуть на з'єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди. У практичному плані найважливішим з кетонів є диметилкетон, або ацетон -CH3COCH3.
Отримання і хімічні властивості кетонів Отримання 1окислення вторинних спиртів
2 отримання за реакцією Кучерова
Хімічні властивості 1 приєднання водню
2 реакції окислення для кетонів протікають лише під дією дуже сильних окислювачів і супроводжуються розривом вуглецевого ланцюга. кетони не дають реакцію срібного дзеркала і не окислюються гідроксидом Купруму(ІІ). 4 Хід роботи: 4.1 Реакція срібного дзеркала. Для одержання "срібного дзеркала", спочатку потрібно добре вимити пробірки. Для цього в них кип’ятять (обережно!) протягом 1-2 хв. по 5 мл 10%-го розчину натрій гідроксиду. Для рівномірного кипіння розчину лугу в нього вкладають кілька кип’ятильних камінців. Потім розчин лугу виливають і пробірки промивають дистильованою водою. У кожну з вимитих пробірок вносять по 1 мл 1%-ного розчину аргентум нітрату і до нього краплями додають 5%-ний розчин амоній гідроксиду доти, поки осад аргентум гідроксиду, який спочатку утворюється, не розчиниться повністю. Необхідно стежити за тим, щоб у реакційній суміші не було надлишку амоніаку, який знижує чутливість реакції. До одержаного безбарвного розчину аміакату аргентум гідроксиду в одну пробірку додають 0,5-1 мл 40%-ного розчину формальдегіду, в другу – 1 мл водного розчину акролеїну, в третю – 1 мл ацетону. Реакційні суміші ставлять у водяну баню і нагрівають кілька хвилин при температурі 60-70°С. Що відбувається? Записати рівняння реакції. Де використовують дану реакцію. 4.2 Реакція відновлення альдегіду гідроксидом міді (ІІ). Дослід проводять у двох пробірках. У кожну пробірку вносять по 1 мл 2%-ного розчину купрум(ІІ) сульфату і 10%-ного розчину натрій гідроксиду. У пробірках утворюється осад купрум(ІІ) гідроксиду. Після цього в одну пробірку додають 0,5-1 мл 40%-ного розчину формальдегіду (формаліну), а в іншу – 1 мл водного розчину акролеїну. Реакційні суміші в пробірках перемішують, а потім нагрівають до початку кипіння тільки верхні їх частини так, щоб нижні частини залишились для контролю холодними. Спостерігають у нагрітих частинах реакційних сумішей виділення осаду купрум(І) гідроксиду СuОH жовтого кольору, який потім перетворюється на осад купрум(І) оксиду Cu2O червоного кольору. Іноді на стінках пробірок виділяється навіть металічна мідь.
Реакції відновлення амоніачного розчину аргентум оксиду та купрум(ІІ) гідроксиду є якісними реакціями на альдегіди. Записати рівняння реакцій. 5 Висновки: 6 Контрольні питання: 6.1 Навести приклади представників гомологічних рядів альдегідів та кетонів. 6.2 Як двома способами довести, що розчин містить альдегід? 6.3 На основі електронних уявлень поясніть, яка будова функціональної групи альдегідів і чим вона відрізняється від функціональної групи спиртів?
Література: 1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989. 2 Буринська Н.М., Величко Л.П. Хімія. Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
|
||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 388; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.151.106 (0.006 с.) |