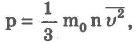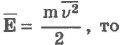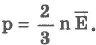Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опытные законы идеального газа уравнение состояния идеального газа.
Модель идеального газа (ИГ) основывается на трех допущениях: – собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда; – силы взаимодействия между молекулами отсутствуют; – столкновение молекул друг с другом и со стенками сосуда в процессе хаотического теплового движения носит упругий характер. Модель ИГ с успехом применяется для описания реальных газов при нормальных условиях (н.у.): P0=101325 Па=760 мм.рт.ст., Т0=273,15 К, а также при высоких температурах и низких давлениях. При иных условиях от уравнения ИГ можно перейти к теории реальных газов, вводя в эти уравнения поправки, учитывающие собственный объем молекул и силы взаимодействия между ними. Простейшие примеры ТД процессов – изопроцессы (постоянной остается масса газа m =const и один из ТД параметров P, V или T). Они описываются экспериментально установленными законами: а) изотермический (m =const, T =const) (рис.9.1, а) закон Бойля–Мариотта (англ. Р. Бойль, фр. Э. Мариотт): PV = const; (9.2) б) изобарный (m =const, P =const) (рис. 9.1, б) закон Ж.Л. Гей-Люссака: V = V 0 (1+ a × t). (9.3) При н.у. (Р0 и Т0) a =1/273,15 K-1; в) изохорный (m =const, V =const) (рис. 9.1, в) закон Ж.Л. Гей-Люссака: P = P 0 (1+ a × t). (9.4) Выражая время t через температуру T законы Гей-Люссака можно переписать в виде:
Рис. 9.1 Закон А. Авогадро: 1 моль любых газов при одинаковых температуре и давлении занимают одинаковый объем. При н.у. молярный объем Vm =22,41×10-3 м3 (22,41 литра), а число частиц в одном моле любого газа NA =6,02×1023 моль-1. Закон Дж. Дальтона: давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь: Парциальное давление – то, которое производил бы газ, входящий в состав смеси, если бы занимал сам весь объем, занимаемый смесью. Основное уравнение молекулярно-кинетической теории идеальных газов. Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения. уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева): PV = n RT где n – число молей газа; P – давление газа (например, в атм; V – объем газа (в литрах); T – температура газа (в кельвинах); R – газовая постоянная (0,0821 л· атм /моль·K).
|
|||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 152; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.178 (0.005 с.) |
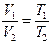 и
и 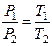 . (9.5)
. (9.5)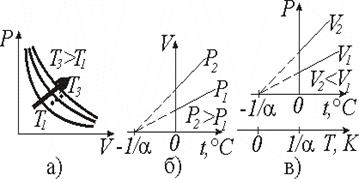
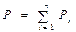 .
.