
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 2. 4 иллюзия фундаментаСодержание книги
Поиск на нашем сайте
История открытий в физике конца XIX – первой половины ХХ века наглядно иллюстрирует процесс создания мифологии в науке. Все началось с открытия электрона. В 1895 г. были открыты “катодные лучи”. Эти “лучи” обеспечивали пропускание электрического тока через вакуумированную трубку. Поскольку в то время было обращено внимание только на тот факт, что приложение внешнего напряжения к электродам, впаянным в вакуумированную трубку, вызывает появление тока через вакуум трубки, было сделано заключение, что “катодные лучи” состоят из заряженных частиц, которые и были названы электронами, которым приписали наличие электрического заряда. Вот так одна ошибка в выводе, сделанная при анализе явления, повлекла за собой длинную цепь ошибочных построений, моделей и теорий. Катодные лучи, сформированные из электронов, распространялись в условиях действия внешнего электрического поля прямолинейно и отклонялись в магнитном поле. Кроме того, было обнаружено, что эти “лучи” вертят детскую вертушку. На основании этого было сделано заключение, что электроны - материальные частицы. Дальнейшие исследования свойств электронов проводились уже на этом фундаменте. В 1897 г. Дж. Дж. Томсон измерил соотношение между массой и зарядом электрона e/m = - 1.76*1011Кл/кг. Только в 1911 г. Малликен измерил величину заряда электрона - 1.6*10-19 Кл. Это то, что мы теперь приняли за единицу заряда. Было определено, масса электрона составляет 9.1*10-19г или 1/1837 массы атома водорода. В самом начале XX века произошло дальнейшее мифотворчество. Гейгер и Марсден обстреливали золотую фольгу α-частицами. Оказалось, что большая часть их проходит через фольгу, не задерживаясь в мишени. На основании этих и своих собственных опытов Резерфорд (1911) предложил ядерную модель атома. Если атом имеет диаметр 1 А, то его ядро 10-5А. Резерфорд, разрабатывая свою модель атома, исходил из того, что атом устойчив. Следовательно, по Резерфорду, электроны в атоме движутся вокруг ядра. Это был элемент ничем не обоснованного предположения, которое привело к различным парадоксам в понимании свойств вещества как такового. Создавая свою модель, Э. Резерфорд (1871-1937) показал, что почти вся масса атома сосредоточена в его ядре - очень небольшой (даже по сравнению с атомом) области пространства. Радиус ядра приблизительно в 100 тысяч раз меньше размера атома. Подобное понимание привело к созданию планетарной модели атома, в которой ядро - Солнце, а электроны – планеты. Поскольку было принято, что электроны движутся вокруг ядра по определенным орбитам, должны быть силы, заставляющие электроны двигаться так, а не иначе. В тот момент существование нейтронов еще не предполагали, что и позволило просто постулировать, что электроны движутся именно так. Это было сделано по красивой аналогии с планетарной системой. Однако сделанное предположение о движении электронов вынудило пойти далее. По этой причине было предположено, что ядро имеет положительный заряд, притягивающий электроны, а вращение электрона по орбите создает силы, не позволяющие электрону упасть на ядро. Опыты Резерфорда показали, что атом любого вещества состоит главным образом из пустоты. Если рассчитать соотношение между объемом ядра атома и объемом самого атома, то окажется, что объем ядра атома пренебрежимо мал, и учитывать наличие ядра необходимо лишь в силу необходимости “оправдания” существования массы атома. Открытие нейтрона, а затем и протона породило новые мифы. Действительно, поскольку кулоновские силы возрастают в квадратичной зависимости от уменьшения расстояния между одноименными зарядами, необходимо было ответить на вопросы о силах, удерживающих нуклоны в составе ядра, поскольку было необходимо ответить на вопрос, что удерживает в ядре нейтроны. Не менее важен был ответ и на такой вопрос: как организованы в составе ядра нейтроны и протоны, поскольку нельзя предположить свободную, произвольную компоновку ядра атома. С открытием нейтрона стало понятно, что ядра состоят из протонов (частиц, реагирующих на внешнее электрическое поле как положительно заряженные частицы) и нейтронов. Атом в целом электрически нейтрален. Поэтому атом естественно было представить себе как ядро, окруженное электронами, число которых равно числу протонов в ядре. Протоны и нейтроны, как строительный материал ядра, получили общее название – нуклоны (с латинского nucleus - ядро). Планетарную модель Резерфорда можно и необходимо было подвергнуть критическому анализу, так как было обнаружено, что на нейтрон не действуют внешние электрические поля. По этой причине и название было подобрано соответствующее – нейтрон. Таким образом, ядро атома оказалось устроено гораздо сложнее, чем это могло быть представлено в планетарной модели. На вопрос об устойчивости ядра был найден “ответ” за счет наличия, якобы, некоторых сил слабого и сильного взаимодействия. Третий вопрос из перечисленных выше – о взаимосвязи нейтронов и протонов - вообще никогда не обсуждался. Таким образом, поскольку отсутствие заряда у электрона не было замечено, пришлось постепенно создавать сложную конструкцию умозрительных построений, которые как-то пытались объяснить наблюдаемые явления. Но на этом число мифов в современной теории строения атома не ограничивается. Согласно модели Резерфорда электрон в атоме водорода движется вокруг протона по замкнутой круговой орбите. Условие устойчивости орбиты - равенство центробежной силы и силы кулоновского притяжения mV 2 / r = e 2 / r 2. В Солнечной системе планеты притягиваются к Солнцу силой гравитации. В атоме, как будто, действует электростатическая сила. Ее часто называют кулоновской в честь Шарля Огюстена Кулона (1736 – 1806), установившего, что сила взаимодействия между двумя зарядами обратно пропорциональна квадрату расстояния между ними. Тот факт, что два заряда Q 1 и Q 2 притягиваются или отталкиваются с силой, равной F C = Q 1 Q 2/ r2, где r - расстояние между зарядами, носит название "Закон Кулона" (закон К). Индекс " С " присвоен силе F по первой букве фамилии Кулона (по-французски Coulomb). Основным недостатком модели атома Резерфорда и Бора, который сразу бросается в глаза, и с которым ни один физик не в состоянии согласится – это круговые траектории орбит электрона вокруг атома. Разумеется, есть и другие траектории движения – “гантелеобразные”, “тарелочки ” и т.д. Но само присутствие в атоме круговых траекторий движения настораживает, так как таких траекторий быть не может, такого быть не должно. Как следует из решения задачи Кеплера – траектории должны быть, как минимум, эллиптическими. И никаких круговых траекторий движения электрона вокруг ядра атома быть не может. Казалось бы, несложно сделать замену, и сказать, что на самом деле траектории движения электрона не круговые, а эллиптические. Но в этом случае, как это следует из решения движения заряда в кулоновском поле (см. Л.Д. Ландау, Е.М. Лифщиц, “Теория Поля” параграф 70, стр. 240) электрон оказывается вынужденным постоянно излучать энергию и, в результате, обязан просто упасть на ядро атома. При эллиптической траектории движения электрона вокруг ядра теряет смысл условие квантования орбит, так как эллиптические траектории движения не квантуются. И в разных точках такой траектории движения электрон имеет разную кинетическую энергию. А это, в свою очередь, противоречит экспериментальным данным по спектру излучения атома. Именно поэтому и считается, что электроны в атоме движутся по круговым траекториям. Не следует думать, что физики до этого не знали. Знали, и очень хорошо знали. Более того, знали об этом и Резерфорд, и Бор. И не следует забывать, что Бор, в свое время, был принят в команду Резерфорда именно в качестве теоретика, призванного объяснить и устранить все недостатки и противоречия планетарной модели атома Резерфорда. Несмотря на достаточно критическое отношение Резерфорда к работе Бора, Нильс Бор опубликовал результаты в 1913 году в журнале “ Философикал Мэгэзин ”. Резерфорд способствовал публикации, поскольку критика атома Резерфорда со стороны Томсона, Рэлея, Зеемана и других была достаточно сильной. И необходимо было отвечать на эту критику. Это сейчас нам кажется, что модель атома Резерфорда и Бора была признана сразу правильной, и не вызвала возражений. На самом деле, ни Томсон, ни Рэлей, ни Зееман не воспринимали всерьез ни модель атома Резерфорда, ни постулаты Бора. И у них были на этот счет очень серьезные аргументы. Обратимся вновь к уравнению устойчивости орбиты для электрона. Внимательное прочтение этой формулы показывает, что она справедлива только для случая, когда каждый электрон взаимодействует только с индивидуальным протоном. Однако по планетарной модели такой вариант предположить невозможно. Более того, протоны, сгруппированные в нечто единое целое согласно этой модели, должны образовывать суммарный заряд, который просто должен немедленно “свалить” электрон на ядро. Однако это еще не все сомнения по поводу корректности планетарной модели атома Резерфорда-Бора. Электрон, обладая зарядом, при своем движении должен создавать магнитный поток, который будет взаимодействовать с такими же потоками от действия других электронов. Когда магнитные поля от движения электронов не суммируются, может появиться “разрывающее” усилие. Следовательно, электроны просто обязаны двигаться по взаимно согласованным траекториям. Таким образом, и в этом случае планетарная модель должна быть пересмотрена. Попытаемся привести еще ряд соображений, которые давно должны были заставить ученых отказаться от планетарной модели атома. В двадцатые-тридцатые годы ХХ века происходило развитие волновой механики (Де Бройль, Шредингер, Гейзенберг). В 1924г. было установлено (точнее следует сказать - принято), что свет представляет собой волны и частицы - фотоны. Первоначально считалось, что электрон - частица: имеет массу, так как оказывает физическое воздействие на легкую вертушку, имеет скорость. Впоследствии было установлено, что электрон может рассматриваться и как волна: имеет фазу, можно определить длину волны, пучок электронов испытывает дифракцию, интерференцию.
Почему это соотношение важно для микрочастиц, но не существенно для макрообъектов? Вот как обосновала ответ на этот вопрос теоретическая физика.
Следующее предположение де Бройля: если электрон движется по круговой орбите не как шарик, а как волна, то на окружности орбиты должно укладываться целое число волн, иначе произойдет затухание волны. Иными словами электрон должен образовывать так называемую стоячую волну (рисунок 2.6). Что из этого следует? Рассмотрим соотношение 2πr = nλ или λ = 2πr/n. Приравнивая это выражение к λ ═ h/m V, получаем 2πr/n = h/mv, а отсюда следует: mvr =n h/2π. Итак, был получен главный постулат Бора, но совсем на других основаниях. Тем самым было получено “подтверждение” планетарной модели. Кстати говоря, за свою волновую модель электрона де Бройль был удостоен Нобелевской премии. Однако на самом деле усилиями де Бройля электрон вообще выродился в нечто неопределенное и уже не может вообще рассматриваться как частица. Все вышесказанное свидетельствует о том, что электрон ”размазан” в атоме. Как это можно себе представить? Для ответа на этот вопрос была “придумана” специальная “уловка”. Ответ на вопрос дал принцип неопределенности Гейзенберга. Основная идея - невозможно в любой данный момент времени определить и положение в пространстве, и импульс (p = mv) электрона. Математически это выражается так: (∆px)(∆x) > h/4π. Здесь ∆px - неопределенность в величине импульса, а ∆x - неопределенность в положении частицы в пространстве. Таким образом, чем точнее удается измерить импульс электрона, тем менее точно мы сможем установить его положение в пространстве. Мы должны принять (на веру), что электрон представляет собой одновременно и частицу и волну. Теперь все резко усложняется, поскольку электрон размазан в атоме и его движение нужно описывать как волновое, приходится вводить так называемую волновую функцию y(x, y, z), описывающую движение электрона как волны. Следим далее за ухищрениями физиков, вводивших все новые и новые правила и ограничения на “поведение” электронов в атоме. Принцип минимума энергии для электронов заключается в том, что электроны стремятся прежде всего занять ближние к ядру орбитали с наименьшей энергией (1s). Принцип Паули: в системе (в атоме) не может быть двух электронов, характеризующихся одним и тем же набором четырех квантовых чисел. Иначе говоря, на одной орбитали могут находиться только два электрона (они отличаются по спину). Другое правило – правило Хунда: каждая система стремится иметь максимальный спин (максимальное число неспаренных электронов). В таком случае максимальное число электронов в слое с главным квантовым числом n равно 2 n 2. n = 1 → 2e; n = 2 → 8e; n =3→ 18e; n = 4 → 32e и т.д. Сначала заполняются уровни (орбитали) с наименьшим n.
При одинаковых n + 1 сначала заполняется орбиталь с меньшим n.
Глядя на рисунок 2.7, можно отметить, что на более удаленных орбиталях могут находиться электроны с меньшей энергией, чем на более близких к ядру орбиталях. Это совершенно очевидный нонсенс, существующий только вследствие искусственности, придуманности модели.
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.144.162 (0.009 с.) |

 В 1924 г. Луи де Бройль предположил, что электроны, подобно фотонам, распространяются волнами. Для фотонов Эйнштейн предложил уравнение, связывающее массу и энергию: E = mc2, при этом известно, что энергия фотона определяется через его частоту: E = hν. Подставив в уравнение энергии E = mc2 скорость движения электрона и приравняв энергию, выраженную через частоту, и энергию по уравнению Эйнштейна, де Бройль получил следующее: m V 2 = hν = h V /λ, где λ - длина волны электрона. Тогда можно получить соотношение между корпускулярными
В 1924 г. Луи де Бройль предположил, что электроны, подобно фотонам, распространяются волнами. Для фотонов Эйнштейн предложил уравнение, связывающее массу и энергию: E = mc2, при этом известно, что энергия фотона определяется через его частоту: E = hν. Подставив в уравнение энергии E = mc2 скорость движения электрона и приравняв энергию, выраженную через частоту, и энергию по уравнению Эйнштейна, де Бройль получил следующее: m V 2 = hν = h V /λ, где λ - длина волны электрона. Тогда можно получить соотношение между корпускулярными 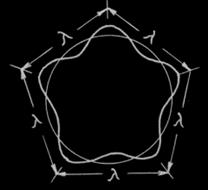 и волновыми свойствами частиц: λ ═ h/m V.
и волновыми свойствами частиц: λ ═ h/m V. Постоянная Планка h = 6.626*10 -34 Дж*с. Если рассмотреть объект, массой 1 г, движущийся со скоростью 1 см/с, то, подставив в λ ═ h/m V, мы получим длину волны λ =6*10 -28 см. А вот если рассмотреть электрон, скорость которого в электрическом поле с напряженностью ∆Е = 100 В равна 6*106м/с, то получим λ = 0.12 нм, т. е. величину, соизмеримую с размерами атома.
Постоянная Планка h = 6.626*10 -34 Дж*с. Если рассмотреть объект, массой 1 г, движущийся со скоростью 1 см/с, то, подставив в λ ═ h/m V, мы получим длину волны λ =6*10 -28 см. А вот если рассмотреть электрон, скорость которого в электрическом поле с напряженностью ∆Е = 100 В равна 6*106м/с, то получим λ = 0.12 нм, т. е. величину, соизмеримую с размерами атома.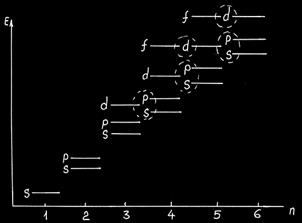 Но существует еще правило - правило Клячковского, согласно которому заполнение орбиталей происходит не по возрастанию n, а по возрастанию n +1.
Но существует еще правило - правило Клячковского, согласно которому заполнение орбиталей происходит не по возрастанию n, а по возрастанию n +1. Здесь приводится гипотетическая картинка (рисунок 2.7) расположения уровней энергии для различных орбиталей. 2 электрона -1s2; 3 электрона - 1s22s1; 4 электрона - 1s22s2; 5 электронов - 1s22s32p1, 6 электронов - 1s22s22p2, причем оба p-электрона неспаренные. Дальше до 18 электронов заполняются только s и p-орбитали. …3s23p6. Следующий 19-й электрон садится не на 3d-орбиталь, а на 4s, согласно вышеприведенному рисунку и правилу Клячковского: 4s n + 1 = 4; 3d n + 1 = 5; 4p n + 1 = 5.
Здесь приводится гипотетическая картинка (рисунок 2.7) расположения уровней энергии для различных орбиталей. 2 электрона -1s2; 3 электрона - 1s22s1; 4 электрона - 1s22s2; 5 электронов - 1s22s32p1, 6 электронов - 1s22s22p2, причем оба p-электрона неспаренные. Дальше до 18 электронов заполняются только s и p-орбитали. …3s23p6. Следующий 19-й электрон садится не на 3d-орбиталь, а на 4s, согласно вышеприведенному рисунку и правилу Клячковского: 4s n + 1 = 4; 3d n + 1 = 5; 4p n + 1 = 5.


