
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы. Эдс и ее измерение.
В рассмотренных выше окислительно-восстановительных реакциях переход электронов от восстановителя – атома активного металла – к окислителю – ионам неактивного металла – происходит непосредственно, поскольку восстановитель соприкасается с окислителем. Обе стадии реакции – окисление активного металла и восстановление неактивного металла пространственно не разделены, т. е. протекают в одном месте – месте соприкосновения активного металла с раствором соли другого металла. Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция: Zn + CuSO4 → ZnSO4 + Cu. или в ионной форме: Zn0 + Cu2+ → Zn2+ + Cu0. Здесь восстановитель – цинк – отдает электроны. Эта полуреакция выражается уравнением: Zn0 – 2ē → Zn2+. Окислитель – ион меди – принимает электроны. Уравнение этой полуреакции имеет вид: Cu2+ + 2ē → Cu0. Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока – по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов первого рода), изготовленных из различных металлов (окислительно-восстановительных пар), погруженных в раствор электролита (чаще – это раствор соли металла). Например, металлический электрод – металл, погруженный в раствор своей соли Mе/Mе n +. Электрод, на котором происходит процесс окисления (анодный процесс), называется анодом. Роль анода играет металл с меньшей алгебраической величиной электродного потенциала, т. е. более активный металл. Электрод, на котором осуществляется восстановление (катодный процесс), называется катодом (металл с большей алгебраической величиной электродного потенциала). Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент (элемент Якоби-Даниэля), образованный двумя электродами первого рода и работающий за счет энергии приведенной выше реакции между цинком и раствором сульфатом меди. Этот элемент состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора или соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала, или не соприкасаются, но взаимосвязь между ними осуществляется посредством проводника второго рода (электролитного мостика.
Схема гальванического элемента Якоби-Даниэля. а) с растворами, соприкасающимися друг с другом; б) с изолированными растворами Работа гальванического элемента при замыкании цепи начинается с того, что электрод, изготовленный из более активного металла, в данном случае из цинка, взаимодействует с полярными молекулами воды, находящимися в соприкасающемся с поверхностью электрода растворе, по уравнению: Zn0 + п Н2О → Zn2+∙ п Н2О + 2ē или в упрощенной форме Zn0 – 2ē → Zn2+. Образовавшиеся гидратированные катионы цинка переходят в раствор, а электроны заряжают отрицательно поверхность электрода. Электрод, на котором этот процесс происходит, получил название анода.Как видно, в данном случае анод заряжается отрицательно. Осуществляется отвод высвобождающихся при этом электронов по внешней цепи с анода на катод в результате соединения цинкового электрода проволокой с медным электродом. На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися катионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Cu 2+∙ п Н2О + 2ē → Cu0 + п Н2О или в упрощенной форме Cu2+ + 2ē → Cu0. Таким образом, на медном электроде идет процесс восстановления меди, в связи с чем электрод, на котором этот процесс происходит, получил название катода. Число электронов, посылаемых в единицу времени анодом, равно числу электронов, проходящих в единицу времени через сечение проводника, и числу электронов, разряжающих в единицу времени катионы на катоде. Суммарное уравнение реакции, протекающей в элементе (токообразующей реакции), получится при сложении уравнений обеих полуреакций: Zn0 + Cu2+ → Zn2+ + Cu0 или в молекулярной форме: Zn + CuSO4 → ZnSO4 + Cu Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи (проводнику первого рода), на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. У цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Сu2+ и Zn2+), движутся от цинкового электрода к медному, а анионы SO42– – в обратном направлении. Движение ионов SO42– в растворе замыкает электрическую цепь гальванического элемента (например, если убрать электролитный мостик, то электрический ток по внешнему проводнику протекать не будет). Таким образом, при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, возникают самопроизвольные процессы растворения цинка (как более активного металла) на аноде и выделения меди (как менее активного металла) из раствора на катоде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не восстановится на медном электроде вся медь). При схематическом изображении гальванического элемента граница раздела фаз между металлом и раствором обозначается одной вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой, которая отделяет анодное пространство от катодного. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Стрелками показано направление движения электронов во внешней цепи гальванического элемента. Например, схема гальванического элемента Якоби-Даниэля изображается следующим образом (молекулярная форма):
Эта же схема может быть изображена в ионной форме:
Поскольку число электронов, которые за единицу времени отдает анод (цинк), равно числу электронов, принимаемых за это же время ионами катода (меди), скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи. Получаемая в процессе работы гальванического элемента энергия электрического тока равна произведению количества электричества, прошедшего от анода к катоду, на напряжение. Максимальное значение этого напряжения называется электродвижущей силой гальванического элемента.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором электродвижущая сила (ЭДС) элемента имеет положительное значение. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя). ЭДС гальванического элемента определяется как разность электродных потенциалов катода и анода: ЭДС = ЕК – ЕА.. В случае элемента Якоби-Даниэля (–)Zn¦Zn2+||Cu2+¦Cu(+) для стандартных условий: ЭДС = Е0Cu – Е0Zn = 0, 34 – (–0, 76) = 1,1 В Для нестандартных условий ЭДС элемента Якоби-Даниэля находится из разности электродных потенциалов, вычисленных по уравнению Нернста. ГЭ может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией. Такие ГЭ называются концентрационными ГЭ. При этом электрод, помещенный в более разбавленный раствор, играет роль анода, а электрод в более концентрированном растворе — роль катода. Электролиз.
Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворенных веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита. Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами – проводниками, соединенными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом – отрицательный. Положительные ионы – катионы – (ионы металлов, водородные ионы, ионы аммония и др.) – движутся к катоду, отрицательные ионы – анионы – ионы кислотных остатков и гидроксильной группы – движутся к аноду. Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде – катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде – аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
В зависимости от того, какие вещества подвергаются электролизу, различают электролиз расплава (присутствует только вещество) и раствора (присутствует и вещество, и вода, которая в ряде случаев может вмешиваться в процесс электролиза). Для протекания электролиза необходимо использовать токопроводящие электроды. Так как металл катода уже является восстановленной формой, то материал катода не оказывает значительного влияния на продукты реакций. Но материал анода сам может подвергнуться окислению в процессе электролиза. Поэтому различают электролиз с инертным или нерастворимым анодом (графитовым, угольным, платиновым и золотым) и с неинертным или растворимым анодом (изготовленным из любого металла, кроме платины и золота). В процессе электролиза такой анод всегда окисляется и разрушается. Примеры электролиза расплавов с инертным анодом:
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
Примеры электролиза растворов с инертным анодом: При электролизе водных растворов следует учитывать, что на катоде в первую очередь восстанавливается та система, электродный потенциал которой имеет максимальное значение. 1. В первую очередь восстанавливаются металлы, имеющие положительную величину электродного потенциала (стоящие в ряду напряжения (СЭП) после водорода): Меn+ + n ē → Ме0 2. В том случае, если значение стандартного электродного потенциала металла имеет промежуточное значение между – 0,41 В и 0 В в нейтральной среде (он занимает промежуточное положение между алюминием и водородом в ряду напряжения), то на катоде протекает преимущественно восстановление металла с незначительным выделение водорода из воды: Меn+ + n ē → Ме0; 2Н2О + 2ē → Н2 + 2ОН− 3. Металлы, имеющие величину электродного потенциала меньше, чем – 0,41 В (стоят в ряду напряжения до алюминия, включая алюминий), из нейтральных растворов не восстанавливаются, а восстанавливается преимущественно водород из воды: 2Н2О + 2ē → Н2↑ + 2ОН− Меn+ + n ОН− → Ме(ОН)n В этом случае образуется гидроксид металла. При записи анодных процессов необходимо учитывать, что на аноде в первую очередь окисляется та система, электродный потенциал которой имеет минимальное значение. 1. В первую очередь окисляется материал анода, если анод металлический: Ме0 – n ē → Ме n+ 2. На аноде протекает окисление кислотного остатка (аниона) в том случае, если значение его электродного потенциала имеет более отрицательное значение, чем потенциала окисления кислорода из воды) Поэтому, кислотный остаток окисляется только в том случае, если он не содержит кислород: Cl−, Br−, I−. 2Cl− – 2 ē → Cl2↑ 3. В случае присутствия в растворе кислородосодержащего аниона (кислотного остатка), например, NO3−, SO42−, РО43− и т.д., на аноде протекает преимущественное окисление кислорода из воды:
2Н2О – 4ē → О2↑ + 4Н+ В этом случае образуется какая либо кислота. Примеры электролиза растворов солей: 1. При электролизе раствора AgNO3 на электродах будут протекать следующие процессы: К) Ag+ + 1е = Ag0 Серебро восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+. А) 2Н2О –4е = О2 + 4Н+ 2. При электролизе раствора CuCl2 на электродах будут протекать следующие процессы: К) Cu2+ + 2е = Cu0 Медь восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+. А) 2Cl– –2е = Cl2 Эта реакция окисления хлора протекает на аноде, так как электролизу подвергается водный раствор соли безкислородной кислоты. 3. При электролизе раствора КОН на электродах будут протекать следующие процессы: К) 2Н2О + 2е = Н2 + 2ОН– Сам калий на катоде восстанавливаться не будет, поскольку стоит в ряду СЭП до алюминия и обладает весьма слабой тенденцией к присоединению электронов, уступая в этом отношении ионам Н+. А) 4ОН– –4е = О2 + 2Н2О Эта реакция окисления кислорода протекает на аноде, так как электролизу подвергается водный раствор щёлочи. 4. При электролизе раствора CuSO4 на электродах будут протекать следующие процессы: К) Cu2+ + 2е = Cu0 Медь восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+. В случае медного анода на нём будет протекать процесс окисления самого металла: А) Cu0 – 2е = Cu2+ В случае угольного (инертного) анода на нём будет протекать процесс электрохимического окисления воды с выделением кислорода, поскольку электролизу подвергается водный раствор соли кислородосодержащей кислоты. А) 2Н2О –4е = О2 + 4Н+ 2Н+ + SO42– = Н2SO4 Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Электролиз находит применение для очистки сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.84.155 (0.065 с.) |
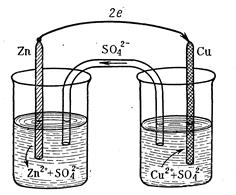 а) б)
а) б)
 Zn ô ZnSO4 ôô CuSO4 ô Cu.
Zn ô ZnSO4 ôô CuSO4 ô Cu.






