
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие об электродных потенциалах. Зависимость величины электродных потенциалов от различных факторов. Уравнение Нернста.
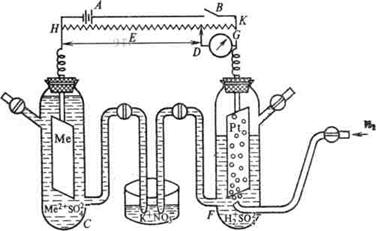
Если металлическую пластинку опустить в воду, то катионы металла на его поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся на металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие: Me + mH2O «Me n+ ∙m H2O + ne в растворе на металле где n – число электронов, принимающих участие в процессе. На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, так называемые стандартные электродные потенциалы (Е0). Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е0=0; DG=0). Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н раствором H2SO4, в котором активность ионов Н+ равна единице. В этот раствор погружен электрод из платины, покрытый платиновой чернью для увеличения поверхности.
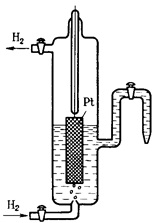
При использовании водородного электрода через раствор H2SO4 пропускают химически чистый водород. Боковая трубка с краном также заполнена раствором серной кислоты и служит для соединения водородного электрода с другим электродом. При контакте пластины с молекулярным водородом происходит адсорбция водорода на пластине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в пластине электроны. При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде:
2Н+ + 2е → Н2 Определив стандартные потенциалы металлов относительно водородного электрода, располагаем их в ряд по мере возрастания алгебраической величины стандартный электродных потенциалов [E0], получаем ряд напряжений. Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов. Чем дальше расположен металл в ряду напряжений, т. е. чем больше его стандартный потенциал, тем более сильным окислителем в водном растворе являются его ионы (и тем легче они принимают электроны), и наоборот, чем ближе металл к началу ряда, т. е. чем меньше значение Е0, тем более сильные восстановительные свойства проявляет простое вещество – металл (и тем легче он электроны отдает). При изменение ряда параметров, например, концентрации или температуры, величину электродного потенциала на поверхности металла можно рассчитать по уравнению Нернста:
где
R – газовая постоянная; Т – температура; F – число Фарадея; n – число электронов, участвующих в электронной реакции; а – активная концентрация ионов металла в растворе. Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры. Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.1.239 (0.004 с.) |
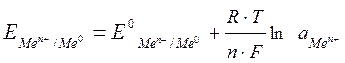 ,
, – электродный потенциал;
– электродный потенциал;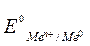 – стандартный электродный потенциал;
– стандартный электродный потенциал; .
.


